Билет 20 Химическая кинетика
(формальная кинетика) Химическая термодинамика и химическая кинетика – две стороны мироздания: первая определяет его устойчивые состояния, характеризует его стабильность и постоянство; вторая символизирует его динамичность, измен-чивость. Химические реакции являются одной из форм движения материи в пространстве и времени. Собственно химическая реакция, т.е. преобразование молекул-реагентов в молекулы-продукты, включает перегруппировку атомов и преобразование их электронных оболочек, это центральное событие вокруг которого обращается вся химия, это сердце химии.
В химической термодинамике нет времени. Химическая кинетика занимается изучением скорости реакций, а также механизмов их протекания. Механизм – это детальное описание отдельных стадий реакции. Для выявления механизма реакции исследуют влияние на её скорость изменений концентраций исходных веществ, продуктов реакции, катализаторов и ингибиторов. При изу-чении скорости реакции необходимо учесть ряд факторов: изменение темпера-туры, природы растворителя, концентрации электролита и изотопного состава реагентов.
|
|
|
Если смешиваются два вещества, то в принципе может образоваться много различных продуктов. Образование каждого из них термодинамически возможно, причем относительные скорости конкурирующих реакций часто оказываются более существенными, для определения состава конечных продуктов, чем условия равновесия. Изменяя концентрации и температуру, а также используя подходящие катализаторы, можно менять соотношение различных конечных продуктов. Только в том случае, если одна из реакций протекает значительно быстрее, чем все остальные, можно получить высокий выход какого-то одного продукта.
Билет 21
Реакции могут быть гомогенными и гетерогенными. Гомогенные реакции протекают в однородной среде, т.е. когда все реагенты находятся в одной фазе(жидкой, газообразной или твердой). Считается единица объема – литр, размер-ность реакции – моль/л*с.
Это реакции газ-газ, жидкость-жидкость. В случае гетерогенной системы, в которой реакция происходит на границе раздела фаз (газообразной и жидкой или твердой, между жидкой и твердой, между двумя жидкими, между двумя твер-дыми). Единицей реакционного пространства служит единица площади меж-фазной поверхности.
Размерность скорости гетерогенных реакции – моль/м2*с
Скорость реакции – изменение количества вещества (исходных веществ или продуктов реакции) в единицу времени, отнесенное к единице реакционного пространства. В случае гомогенной системы к единице объема, в гетерогенной – к единице площади.
|
|
|
Билет 22
Скорость реакции – изменение количества вещества (исходных веществ или продуктов реакции) в единицу времени, отнесенное к единице реакционного пространства. В случае гомогенной системы к единице объема, в гетерогенной – к единице площади.
Скорость химических реакций.Если в момент времени τ1 и τ2 концентрация исходных веществ, например вещества А в реакции
A+B –>C+D
Равны С1 и С2, то средняя скорость V в интервале времени τ1 и τ2 можно выразить как
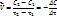
Знак минус указывает на убыль концентрации вещества А.
Мгновенная скорость реакции выражается первой производной концентрации по времени.
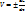 ;
; 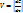
О принципиальной возможности протекания реакции судят по величине  G. Однако её величина ничего не говорит о реальной возможности протекания реакции в данных конкретных условиях, не даёт никакого представления о ско-рости процесса и его механизме.
G. Однако её величина ничего не говорит о реальной возможности протекания реакции в данных конкретных условиях, не даёт никакого представления о ско-рости процесса и его механизме.
Билет 23
Скорость реакции в момент τ – мгновенная скорость Vτ – подчиняется закону действующих масс, который был экспериментально открыт и теоретически обоснован в середине XIX столетия и получил свое название от термина «действующая масса» – синонима современного понятия «концентрация».
Рассмотрим взаимодействие молекулы А с молекулой В в неком объеме (рис. 5.1).
Пусть реакция происходит в некоторой точке R через предшествующее взаимодействию столкновение. Если молярные концентрации веществ А и В выразить через их символы в квадратных скобках, то вероятность нахождения веществ А в точке R будет пропоциональна [A], т. е. ωA=α[A]. Вероятность ωB нахождения вещества в этой точке равна ωB = β[B], а вероятность их одновременного присутствия в точке R (точке столкновения) равна произведению ωA∙ωВ = α[A]∙β[B]. Поскольку только часть столкновений приводит к химической реакции, то скорость реакции образования АВ равна VAB = γ∙α[A]∙β[B] = γ α β [A] [B]. Обозначив γ·α·β = k, получаем для реакции A + B, VAB = k [A] [B]
Коэффициент пропорциональности называют константой скорости. Очевидно, для реакции aA + bB, то есть для a молей вещества А и b молей вещества В ЗДМ формально запишется в виде 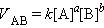
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов. Это определение относится к гомогенным реакциям. Если реакция геторогенная (реагенты находятся в разных агрегатных состояниях), то в уравнениие ЗДМ входят только жидкие или только газообразные реагенты, а твердые исключаются, оказывая влияние только на константу скорости k. Константа скорости k численно равна скорости, если концентрации реагентов постоянны и равны единице.Закон действующих масс безусловно выполняется только для элементарных химических реакций, протекающих в одну стадию. В других случаях фактическая и вычисленная по закону действующих масс скорости совпадают редко.
Билет 24
Зависимость скорости реакции от температуры.
При повышении температуры увеличивается число молекул, обладающих энергией, достаточной для активных столкновений, увеличивается и число эффек-тивных столкновений, приводящих к химическому взаимодействию. Следователь-но, с повышением, температуры увеличивается и скорость химических реакций.
Для количественного описания температурных эффектов в химической кинетике используют 2 основных соотношения – правило Якоба Вант-Гоффа и уравнение Аррениуса.
Правило Вант-Гоффа. При повышении температуры на каждые 10о скорость реакции увеличивается примерно в 2-4 раза.
Аррениус установил, что скорость химической реакции падает с по-нижением температуры. Считалось, что вблизи абсолютного нуля развитие химических реакций невозможно. Но выяснилось, что при предельно низких температурах закон Аррениуса перестает действовать.
|
|
|
Академик В.И. Гольданский объясняет, что при низких температурах от-падает энтропийный фактор (рассеивание тепла), играющий очень важную роль в термодинамике химических реакций.
 2018-01-21
2018-01-21 578
578







