Как и в случае гомогенной химической реакции, константа гетерогенного равновесия равна отношению произведения равновесных концентраций (активностей) или парциальных давлений продуктов реакций к произведению равновесных концентраций (активностей) или парциальных давлений исходных веществ в степенях, равных стехиометрическим коэффициентам в уравнении.
Из приведенных выражений следует, что в уравнения констант гетерогенного химического равновесия не входят концентрации твердых веществ, участвующих в прямой и обратной реакциях. Это особенность гетерогенного химического равновесия.
Так как прямая и обратная реакции протекают на одной и той же поверхности раздела фаз, то площадь поверхности раздела фаз также не входит в уравнение константы химического равновесия.
Константа гетерогенного химического равновесия зависит от температуры. Она возрастает с увеличением температуры для эндотермической прямой реакции и уменьшается с увеличением температуры в случае экзотермической прямой реакции. Расчеты проводятся по тем же формулам, что и для гомогенных реакций.
Смещение равновесия гетерогенных реакций подчиняется принципу Ле Шателье. При повышении температуры оно смещается в сторону эндотермической реакции. При повышении давления или концентрации исходных веществ равновесие смещается в сторону образования продуктов реакции, при повышении концентрации или давления продуктов реакции равновесие смещается в сторону обратной реакции. При повышении общего давления равновесие сдвигается в направлении уменьшения числа молекул газообразных веществ.
Твердые исходные вещества и продукты реакции не влияют на смещение гетерогенного химического равновесия.
Билет 30=билет 31
В общем виде правило фаз Гиббса формулируется следующим образом: число термодинамических степеней свободы, или вариантность равновесной термодинамической системы С, определяется как разность числа независимых компонентов системы К и числа сосуществующих фаз Ф плюс число внешних факторов n, влияющих на равновесие. Его математическое выражение записывается в виде простого соотношения: С = К – Ф + n. Анализируя это выражение можно сделать следующие выводы:
-число степеней свободы равновесной системы возрастает с увеличением числа независимых компонентов и понижается с увеличением числа сосуществующих фаз;
- число степеней свободы может быть равно либо нулю, либо целому положительному числу, т.е. С³0;
- так как число степеней свободы не может быть отрицательным, то число сосуществующих фаз в равновесной термодинамической системе в общем случае не может превышать суммы К + n.
Числом термодинамических степеней свободы, или вариантностью равновесной термодинамической системы С, называют максимальное число независимых интенсивных термодинамических параметров состояния фаз равновесной системы, произвольное и независимое изменение которых в определенных пределах не влияет на качественный и количественный состав системы, а именно не вызывает исчезновения одних и образования других фаз.
Независимыми компонентами называют составляющие систему вещества, наименьшее число которых необходимо и достаточно для образования и однозначного выражения состава каждой фазы данной системы при любых условиях ее существования
Билет 32 Катализ
Катализ – изменение скорости химической реакции в присутствии ката-лизаторов. Катализ называется положительным, если скорость реакции увели-чивается, и отрицательным, если скорость реакции уменьшается. При гомогенном катализе реагенты и катализатор находятся в одной фазе, при гетерогенном ката-лизе – в разных фазах.
Катализ – вещество, участвующих в реакции и изменяющие её скорость, но остающееся неизменным после того, как химическая реакция заканчивается. Ка-тализатор, замедляющий реакцию, называется ингибитором. Биологические ката-лизаторы белковой природы называется ферментами.
Механизм действия катализаторов состоит, что они образуют промежуточ-ные соединения с исходными веществами и тем самым изменяют путь реакции, причем новый путь характеризуется другой высотой энергетического барьера, т.е. энергия активации изменяется по сравнению с не катализируемой реакцией. В случае положительного катализа она уменьшается, а отрицательного – увели-чивается. Катализатор не может повлиять ни на тепловой эффект реакции ΔН, ни на ΔG реакции, ни на константу равновесия(в случае обратимой реакции). В последнем случае, катализатор изменяет лишь время достижения равновесного состояния, но не термические характеристики.
Большинство химических реакций протекающих в пищеварительном тракте, в крови, в клетках человека и животных, являются каталитическими реакциями, они ускоряются ферментами – белковыми веществами. Так, слюна содержит фер-мент птиалин, который катализирует превращение крахмала в сахар. Расщепление белков в желудке катализируется ферментом – непсином.
Ферменты – исключительно активные катализаторы, их действие отличается высокой избирательностью.
Активность того или иного катализатора может быть резко повышена или понижена различными добавками. Добавки, увеличивающие активность катали-затора называют промоторами.
Гомогенный катализ.
Простейшая схема гомогенного катализа включает обратимое образование промежуточного комплекса катализатора (К) с одним из реагирующих веществ и превращение этого комплекса в продукты реакции с высвобождением К.



Многие гомогенные реакции катализируются кислотами или основаниями реакции, катализируемые ионами ***** или OH- относят к специфическому кис-лотному или основному катализу.
Механизм гетерогенного катализа связан с явлением адсорбции – это поглощение газов, паров и растворенных веществ поверхностью твердого тела.
Молекулы внутри твердого тела имеют скомпенсированное силовое поле, снаружи молекулы обладают частично не скомпенсированным силовым полем, т.е. избытком энергии. За счет избыточной энергии и происходит протяжение молекул газов, паров и растворенных веществ. Их концентрация увеличивается, а следовательно увеличивается и скорость реакции.
Гетерогенный катализ всегда начинается с адсорбции молекул исходных веществ на поверхности твердого катализатора. При этом только обратимая адсорбция является началом каталитической реакции. Необратимая хемосорбция приводит к образованию на поверхности катализатора устойчивых соединений и тем самым к снижению активности катализатора.
При обратимой адсорбции молекул исходных веществ поверхностью твер-дого катализатора происходит ослабление связей между атомами в молекулах адсорбата. За этот счет снижается энергия активации катализируемой реакции, течение которой с высокой скоростью осуществляется на поверхности катализа-тора.

Катализ – наиболее эффективный метод интенсификации промышленных химических процессов. Получение новых материалов, решение проблем окружа-ющей среды(очистки сточных вод и газовых выбросов).
Свыше 90% химической продукции получается в реакциях, где используется катализ.
Билет 33
По механизму протекания реакции делятся на простые, радикальные и ионные.
Простые реакции протекают между молекулами веществ, встречается редко.
Радикальные с участием атомов, имеющих повышенную реакционную способность и называется свободными радикалами
Ионные реакции протекают между ионами.
AgNO3 + NaCl = NaNO3 + AgCl
Ag+ + NO3− + Na+ + Cl− = AgCl + Na+ + NO3−
Ag+ + Cl− = AgCl
Билет 34
Растворы – термодинамически устойчивые системы переменного состава, состоят не менее чем из двух компонентов и продуктов их взаимодействия. Это дисперсные системы, состоящие из дисперсной фазы и дисперсионной среды
В зависимости от агрегатного состояния растворителя различают газообразные, жидкие и твердые растворы.
Газообразными растворами являются воздух и другие смеси газов.
К жидким растворам относят гомогенные смеси газов, жидкостей и твердых тел с жидкостями.
Твердыми растворами являются многие сплавы, например, металлов друг с другом, стёкла.
Концентрация — величина, характеризующая количественный состав раствора.
Массовая доля
Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах.
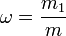 ,
,
 2018-01-21
2018-01-21 4728
4728
