В растворах некоторых электролитов диссоциирует лишь часть молекул. Для количественной характеристики электролитической диссоциации было введено понятие степени диссоциации. Отношение числа молекул, диссоциированных на ионы, к общему числу молекул растворённого электролита называется степенью диссоциации α.
Электролиты, степень диссоциации которых в растворах меньше единицы и уменьшается с ростом концентрации, называют слабыми электролитами. К ним относят воду, ряд кислот, основания p-, d-, f-элементов. В растворах слабых электролитов процесс диссоциации протекает обратимо и, следовательно, к нему может быть применен закон действующих масс. Так, для процесса диссоциации кислоты HA ↔ H + A константа равновесия Кс равна Кс = Кд = ([H][A])/[HA].
Константа равновесия для процесса диссоциации называется константой диссоциации Кд. Например, константа диссоциации уксусной кислоты CH3COOH равна
Кд = ([H][CH3COO])/[CH3COOH]. C повышением температуры константа диссоциации обычно уменьшается, что в соответствие с принципов Ле-Шателье свидетельствует об экзотермическим характере реакции. Константа диссоциации указывает на прочность молекул в данном растворе. Чем меньше константа диссоциации в данном растворителе, тем слабее диссоциирует электролит и тем, следовательно, устойчивее его молекулы. Степень диссоциации α изменяется с концентрацией раствора. Рассмотрим зависимость степень диссоциации от концентрации слабого электролита на примере уксусной кислоты.
CH3COOH ↔ CH3COO + H. Принимая исходную концентрацию кислоты равной c, а степень диссоциации α, получаем, что концентрация части кислоты, которая диссоциирована, будет равна αc. Концентрация кислоты, оставшейся в недиссоциированном состоянии, будет равна c – αс = c(1 – α). Подставив значения равновесных концентраций ионов и кислоты в уравнение константы диссоциации, получим: Кд = (α²c²)/c(1 – α) = (α²c)/(1-α) = α²/(1-α)V, где V = 1/c. Это уравнение было получено Оствальдом и называется законом Оствальда. Если α << 1, то уравнение упрощается: Кд ≈ α²c и α≈√Кд/c. Это уравнение называется законом разбавления Оствальда. Из него следует, что степень диссоциации уменьшается с увеличением концентрации слабого электролита. Изотонический коэффициент характерезует отклонение от законов идеальных растворов вследствие электролдитической диссоциации электролитов.
Вопрос 26 Диссоциация воды - разложение воды на составляющие химические элементы, иногда происходящая с созданием новых элементов, изначально в разлагаемом растворе не содержащихся, или содержащихся до начала разложения в меньшем количестве, чем после завершения процесса диссоциации.
Диссоциация воды является эндотермической реакцией (см.эндотермическая реакция), т.е. идущей с поглощением теплоты из окружающей среды.
Известные способы диссоциации воды:
1. Электролиз водных растворов-электролитов. - наименее эффективный из известных на сегодня способв разложения воды, так как в этом случае энергия затрачивается, в основном, на нагрев проводника - электролита, настолько, что диссциируемый раствор не только не охлаждается, но, напротив, подвергается значительному нагреву. В промышленности XX века именно этот способ получил наибольшее растпространение, в силу того, что обеспечивает спрос и позволяет поддерживать высокие цены на такой товар, как невосполнимые энергоресурсы, из которых получают электричество, таких как нефть, газ, каменный угль и т.п.
2.Модель процесса разложения воды в центробежном поле Например, во вращающийся барабан заливается подогретый электролит, в котором при вращении в результате начинающегося электрохимического процесса происходит разложение воды на водород и кислород. Этот процесс разлагает воду с помощью кинетической энергии внешнего источника и тепловой энергии подогретого электролита. На основе данного процесса имеется ряд патентов, один из которых (RU 98/00190 (22.06.1998)) авторы - Кудымов Г.И и Студенников В.В. позиционируют, в том числе, и как и тепловой насос, поглощающий теплоту окружающей среды, таким образом, получение водородно-кислородной смеси здесь производится, в значительной мере за счет энергии окружающей среды или за счет обычно безвозвратно теряемого тепла, например выхлопных газов двигателей внутреннего сгорания.
Водоро́дный показа́тель, pH (произносится «пэ аш», английское произношение англ. pH — piː'eɪtʃ «Пи эйч») — мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр:
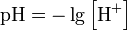
Вопрос 27 Электродный потенциал, разность электростатических потенциалов между электродом и находящимся с ним в контакте электролитом. Возникновение электродный потенциал обусловлено пространственным разделением зарядов противоположного знака на границе раздела фаз и образованием двойного электрического слоя. На границе между металлическим электродом и раствором электролита пространственное разделение зарядов связано со следующим явлениями: переносом ионов из металла в раствор в ходе установления электрохимического равновесия, кулоновскойадсорбцией ионов из раствора на поверхность металла, смещением электронного газа за пределы положительно заряженного ионного остова кристаллической решетки, специфической (некулоновской) адсорбцией ионов илиполярных молекул растворителя на электроде и др. Последние два явления приводят к тому, что электродный потенциал не равен нулю даже при условиях, когда заряд поверхности металла равен нулю.
Абсолютную величину электродный потенциал отдельного электрода определить невозможно, поэтому измеряют всегда разность потенциалов исследуемого электрода и некоторого стандартного электрода сравнения электродный потенциал равен эдс электрохимической цепи, составленной из исследуемого и стандартного электродов (диффузионный потенциалмежду разными электролитами, обусловленный различием скоростей движения ионов, при этом должен быть устранен). Для водных растворов в качестве стандартного электрода обычно используют водородный электрод (Pt, Н2[0,101 МПа] | Н+[ a = 1]), потенциал которого при давлении водорода 0,101 МПа и термодинамической активности а ионов Н+ в растворе, равной 1, принимают условно равным нулю (водородная шкала электродных потенциалов). При схематическом изображении цепи водородный электрод всегда записывают слева; например, потенциал медного электрода в растворе соли меди равен эдс цепи Pt, H2|HCl CuCl2|Cu|Pt (две штриховые черты означают, что диффузионный потенциал на границе НСl и СuСl2 устранен).
Если исследуемый электрод находится в стандартных условиях, когда активности всех ионов, определяющих электродный потенциал, равны 1, а давление газа (для газовых электродов) равно 0,101 МПа, значение электродный потенциал наз. стандартным (обозначение E °).
Оно связано со стандартным изменением энергии Гиббса 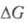 и константой равновесия К рэлектрохимической реакции уравнением:
и константой равновесия К рэлектрохимической реакции уравнением: 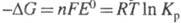 , где F - число Фарадея; n - число электронов, участвующих в реакции; R -газовая постоянная; Т - абс. температура. Значения E ° электрохимических систем по отношению к водородному электроду и протекающие на электродах реакции сведены в специальные таблицы.
, где F - число Фарадея; n - число электронов, участвующих в реакции; R -газовая постоянная; Т - абс. температура. Значения E ° электрохимических систем по отношению к водородному электроду и протекающие на электродах реакции сведены в специальные таблицы.
Зависимость электродного потенциала от термодинамических активностей ai участников электрохимической реакции выражается уравнением Нернста:
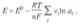
где v i - стехиометрический коэффициент участника реакции, причем для исходных веществ это отрицательная величина, а для продуктов реакции - положительная.
Если через электрод протекает электрический ток, электродный потенциал отклоняется от равновесного значения из-за конечной скорости процессов, происходящих непосредственно на границе электрод – электролит.
 2018-01-21
2018-01-21 965
965








