Водородный электрод состоит из платинированной пластины, контактирующей с газообразным водородом, находящимся под давлением 100 кПа, и раствором, в котором активность ионов H+ равна единице. Водородный электрод относится к газовым электродам, т.е. электродам, в которых по крайней мере одни из реагентов является газообразным. Так как для протекания электродной реакции необходим подвод и отвод электродов, то газовые электроды содержат проводники 1-го рода, которые непосредственно в реакции не участвуют (их ионы не переходят в раствор) и в ходе реакции не меняются. В качестве проводника 1-го рода для стандартного водородного электрода служит платина. При контакте платины с молекулярным водородом происходит адсорбция водорода на платине. Адсорбированный водород, взаимодействуя с молекулами воды, переходит в раствор в виде ионов, оставляя в платине электроны. При этом платина заряжается отрицательно, а раствор – положительно. Возникает скачок потенциала между платиной и раствором. Наряду с переходом ионов в раствор идёт обратный процесс восстановления ионов H+ с образованием молекул водорода. Равновесие на водородном электроде можно представить в виде 2H+ + 2e ↔ H2. Абсолютное значение потенциала водородного электрода неизвестно, но условно считают за нуль потенциал стандартного водородного электрода, т.е. потенциал при 100 кПа и aH = 1 моль/л.
Вопрос 29 ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
Гальванические элементы являются источниками постоянного напряжения и называются первичными элементами. Электрическая энергия, получаемая в этом случае, образуется в результате химических реакций, происходящих внутри элемента. Рассмотрим принцип действия простейшего гальванического элемента.
Элемент состоит из сосуда с раствором серной кислоты (H2SО4), в которую погружены две разнородные пластины: цинковая и медная. Как показал опыт, цинк в этом случае заряжается отрицательно, а медь — положительно. Элемент имеет два вывода — полюса: положительный (анод) и отрицательный (катод).
Цинковая пластина, опущенная в раствор серной кислоты, будет растворяться в ней. Способность цинка легко отдавать свой электроны приводит к тому, что атом цинка,.оставляя два своих электрона пластине,.Переходит в раствор в виде положительного иона. Между цинковой пластиной и раствором возникает некоторая разность потенциалов, которая приостанавливает дальнейшее растворение цинковой пластины.
Опустим в раствор медную пластину. Обладая меньшей способностью растворения, медь по отношению к раствору будет иметь иную разность потенциалов, чем цинк. Таким образом, между медной и цинковой пластинами образуется разность потенциалов.
Разность потенциалов (э. д. с.) между пластинами (электродами) медно-цинкового элемента равна 1,1 в.
Гальванические элементы применяются для питания батарейных радиоприемников, некоторых физических и электроизмерительных приборов, переносных осветительных приборов, сигнализации.
Вопрос 30 Лекланше элемент.Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих вэлектрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
[править]Вывод уравнения Нернста
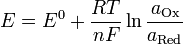 ,
,
где
 — электродный потенциал,
— электродный потенциал,  — стандартный электродный потенциал, измеряется в вольтах;
— стандартный электродный потенциал, измеряется в вольтах;
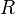 — универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
— универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
 — постоянная Фарадея, равная 96485,35 Кл·моль−1;
— постоянная Фарадея, равная 96485,35 Кл·моль−1;
 — число моль электронов, участвующих в процессе;
— число моль электронов, участвующих в процессе;
 и
и  — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
Если в формулу Нернста подставить числовые значения констант 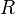 и
и  и перейти от натуральных логарифмов к десятичным, то при
и перейти от натуральных логарифмов к десятичным, то при  получим
получим

Концентрационный элемент — это гальванический элемент, состоящий из двух одинаковых металлических электродов, опущенных в растворысоли этого металла с различными концентрациями С1 > С2. Катодом в этом гальваническом элементе является электрод погруженный в раствор с большей концентрацией, а анодом соответственно погруженным в раствор с меньшей концентрацией.
В качестве примера концентрационного элемента можно привести концентрационный свинцовый гальванический элемент. Электроды этого элемента сделаны из свинца, при этом один из электродов которого погружен в раствор соли свинца с концентрацией Pb2+ равной 0,1 моль/л, а другой — в раствор с концентрацией Pb2+ равной 0,01 моль/л.
Схема данного элемента: 
В данном элементе происходят электродные процессы:
 - реакция восстановления
- реакция восстановления
 - реакция окисления
- реакция окисления
Поляризация и деполяризация
В процессе работы гальванического элемента поверхности электродов изменяются, а это вызывает изменение значений электродных потенциалов анода и катода и уменьшение разности потенциалов, возникающей в первый момент после замыкания элемента.
Связанное с работой гальванического элемента изменение электродных потенциалов анода и катода, следствием чего является уменьшение первоначальной разности потенциалов между ними и уменьшение тока, а также скорости коррозии, называется поляризацией.
Общее уменьшение разности потенциалов электродов в элементе может происходить как за счет смещения потенциала анода в положительную сторону (анодная поляризация), так и за счет смещения потенциала катода в отрицательную сторону (катодная поляризация).
Коррозионное разрушение металла происходило бы в десятки и тысячи раз быстрее, если бы в результате поляризации не происходило уменьшения первоначальной разности потенциалов между анодом и катодом.
Поляризация может быть вызвана наличием в составе электрода примесей других металлов, рассеянных в виде кристалликов; обрастанием поверхности электрода пузырьками водорода или образованием на поверхности электродов пленок из продуктов коррозии.
Явлению поляризации электродов противостоит деполяризация — уничтожение или ослабление поляризации и восстановление электрохимической активности электрода. Вещества, которые, вступая в реакцию с веществом, вызвавшим поляризацию, ослабляют или уничтожают последнюю, называются деполяризаторами.
Начало формы
Лекланше элемент, гальванический элемент, в котором положительный электрод изготавливается из двуокиси марганца с добавкой графита и сажи, отрицательный — из цинка. Л. э. был предложен в 1865 французским химиком Ж. Лекланше (G. Leclanche) и первоначально состоял из цинкового стаканчика, заполненного водным раствором хлористого аммония или др. хлористых солей (электролит), с помещенным в него агломератом из двуокиси марганца с угольным токоотводом. В более поздних конструкциях «сухих» Л. э. электролит стали загущать крахмалистыми веществами. Начальное напряжение такого Л. э. — 1,4—1,6 в, конечное — 0,7—0,9 в, удельная энергия (w) 30—50 вт · ч/кг. В 30 — 40-х гг. 20 в. были разработаны Л. э. галетной конструкции с w 40—60 вт · ч/кг. В 60-х гг. появились Л. э. со щелочным электролитом — раствором едкого кали (1,4—1,66; 0,9—1,0 б; w 60—90 вт · ч/кг), которые стали постепенно вытеснять Л. э. с солевым электролитом. Л. э. — наиболее дешёвые и удобные химические источники тока: они хорошо сохраняются, транспортабельны, не требуют специального ухода, всегда готовы к действию. Широко применяются для питания переносной радиоаппаратуры, карманных фонарей, электрочасов, электроигрушек и т. п.
Вопрос 31 Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций наэлектродах, который возникает при прохождении электрического тока через раствор либо расплав электролита.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создается электродами — проводниками, соединёнными с полюсами источника электрической энергии. Анодом при электролизе называется положительный электрод, катодом — отрицательный[1]. Положительные ионы — катионы — (ионы металлов, водородные ионы, ионыаммония и др.) — движутся к катоду, отрицательные ионы — анионы — (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Явление электролиза широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия, водорода, а также гидроксида натрия, хлора, хлорорганических соединений[ источник не указан 1081 день ], диоксида марганца[2],пероксида водорода. Большое количество металлов извлекаются из руд и подвергаются переработке с помощью электролиза (электроэкстракция,электрорафинирование).
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации).
Первый закон Фарадея
Основная статья: Законы электролиза Фарадея
В 1832 году Фарадей установил, что масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит:

если через электролит пропускается в течение времени t постоянный ток с силой тока I. Коэффициент пропорциональности  называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
[править] Вывод закона Фарадея
 (1)
(1)  (2)
(2)  (3)
(3) 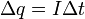 (4)
(4)  , где z — валентность атома (иона) вещества, e — заряд электрона (5)
, где z — валентность атома (иона) вещества, e — заряд электрона (5)
Подставляя (2)-(5) в (1), получим

 где
где  — постоянная Фарадея.
— постоянная Фарадея.


Второй закон Фарадея
Электрохимические эквиваленты различных веществ относятся, как их химические эквиваленты.
Химическим эквивалентом иона называется отношение молярной массы A иона к его валентности z. Поэтому электрохимический эквивалент

где  — постоянная Фарадея.
— постоянная Фарадея.
Второй закон Фарадея записывается в следующем виде:
 где
где  — молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, г/моль;
— молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, г/моль;  — сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А;
— сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А;  — время, в течение которого проводился электролиз, с;
— время, в течение которого проводился электролиз, с;  — постоянная Фарадея, Кл·моль−1;
— постоянная Фарадея, Кл·моль−1;  — число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного). Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).
— число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного). Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).
Вопрос 32
Электролиз – это совокупность процессов, проходящих на электродах при прохождении электрического тока через раствор или расплав электролита. Электролиты – проводники второго рода. При электролизе катод служит восстановителем (отдает электроны катионам), а анод – окислителем (принимает электроны от анионов). Сущность электролиза состоит в осуществлении за счет электрической энергии химических реакций – восстановления на катоде (К) и окисления на аноде (А). Эти процессы называются процессами (реакциями) электровосстановления и электроокисления. Восстановительное и окислительное действие электрического тока во много раз сильнее действия химических окислителей и восстановителей. Различают электролиз расплавов и растворов электролитов.
 2018-01-21
2018-01-21 5891
5891

 —
—