Принцип потенциометрического определения рН растворов основано на использовании гальванического элементу, что состоит с насыщенного хлорсеребряного электрода (сравнение) и стеклянного электрода (измерительного), ЕДС которого зависит от активности ионов водорода в растворе. Для измерения рН используют такие растворы: кислый раствор, желудочный сок, мочу, кишечный сок, щелочной раствор. Измерение рН растворов проводится с помощью рН-метра
Потенциометрическое титрование. Кривые потенциометрического титрования.
Потенциометрический метод титрования основан на измерении потенциала электрода, погруженного в раствор. Величина этого потенциала пропорциональна концентрации соответствующих ионов в растворе. Электрод, по потенциалу которого судят о концентрации определяемых ионов в растворе, называют индикаторным электродом. Потенциал индикаторного электрода определяют, сравнивая его с постоянной величиной потенциала электрода сравнения. Обычно в качестве электрода сравнения применяют нормальный водородный электрод или каломельный электрод.
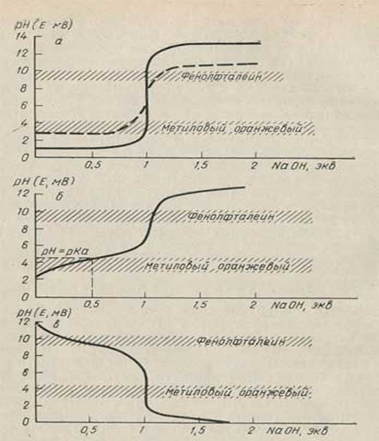
а - кривая нейтрализации хлористоводородной кислоты едким натром; б - кривая нейтрализации уксусной кислоты едким натром; в - кривая нейтрализации аммиака хлористоводородной кислотой. Зависимость величины потенциала индикаторного электрода от концентрации раствора позволяет установить точку эквивалентности при титровании, так как в этой точке концентрация определяемого иона становится ничтожно малой, что в свою очередь приводит к резкому изменению (скачку) потенциала. Потенциометрическое титрование может успешно использоваться для титрования окрашенных и мутных растворов, слабых кислот и оснований, смесей кислот или оснований, смесей окислителей или восстановителей в неводных средах, для определения рН исследуемых растворов и т. д.
 2018-01-21
2018-01-21 2313
2313







