Завдяки наявності іонів рівновага у розчинах електролітів суттєво відрізняється від рівноваги оборотних реакцій у розчинах неелектролітів. Взаємодія іонів між собою і з недисоційованими молекулами, а також з полярним розчинником може приводити до змінення ступеня дисоціації і розчинності.
Обов'язковою умовою протікання реакцій між електролітами є видалення із розчину тих чи інших іонів, тобто реакції у розчинах електролітів завжди спрямовані у бік утворення найменш дисоційованнх або найменш розчинних речовин.
Зв’язок між ступенем дисоціації, концентрацією розчину і константою електролітичної дисоціації встановлює закон розведення Оствальда.
Для його виведення запишемо рівняння електролітичної дисоціації слабкого бінарного електроліту KtAn, у якому символом Kt позначений катіон, а An – аніон:

Позначимо вихідну молярну концентрацію електроліту через С (моль/л), тоді концентрація тієї частини електроліту, яка піддалася дисоціації, з урахуванням ступеня дисоціації дорівнює aC. Як видно з рівняння реакції, утворюються однакові кількості йонів обох знаків, причому, їх концентрації дорівнюють концентрації продисоційованої частини електроліту:
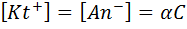
а концентрація недисоційованих молекул:

Підставляючи значення концентрацій у вираз константи дисоціації, одержимо: математично виражений закон розведення Оствальда.

У тому випадку, коли електроліт дуже слабкий, ступінь дисоціації має невелике значення (a  0), яким можна знехтувати, тоді знаменник у рівнянні прирівнюється до одиниці, а закон розведення набирає вигляду:
0), яким можна знехтувати, тоді знаменник у рівнянні прирівнюється до одиниці, а закон розведення набирає вигляду:

звідки ступінь дисоціації

Рівняння дає можливість сформулювати закон розведення Оствальда:
у міру розведення розчину (тобто зменшення концентрації електроліту) ступінь його електролітичної дисоціації підвищується.
 2018-01-21
2018-01-21 1625
1625








