Спрощене рівняння дисоціації води Н2О=Н+ОН
Йони Н у водному росчині миттєво приєднуються до молекул Н2О (гідратуються з утворенням йонів гідроксонію Н3О+
Н2О+ Н+= Н3О+
Отже, рівняння автопротолізу води 2Н2О= Н3О+ +ОН-
Для спрощення і зручності користуються першим рівнянням, Кд н2о= [ Н+] * [ОН-] / [Н2О],
Де Кд н2о – константа дисоціації Н2О= 1,8*  моль/л
моль/л
[ Н+]- молярна концентрація йонів Н+
[ОН-]- молярна концентрація ОН-
[Н2О] – молярна концентрація Н2О
[Н2О] =  =
=  =55,56 л / моль
=55,56 л / моль
Кд н2о= [Н2О] = [ Н+] * [ОН-]== 1,8*  * 55,56= 1 *
* 55,56= 1 *  моль2/л2
моль2/л2
Таким чином добуток іонів позначаємо Кв= [ Н+] * [ОН-]=  моль2/л2, де Кв – іонний добуток води
моль2/л2, де Кв – іонний добуток води
[ Н+] = [ОН-]=  моль/л
моль/л
Отже, вода слабка кислота і слабка основа, оскільки К [ Н+] дуже мала, та при обчисленнях не зручно користуватися значенями у відносному ступені, тому показник іонів Н+ позначається рН.
рН= -lg[ Н+]
Водневий показник рН – відємний десятковий логарифм концентрації іонів гідрогену
рОН -lg[ ОН-]
за відомими значеннями рН можна оцінити кислотність будь-якого розчину.
рН біологічних рідин
плазма крові – 6,7
шлунковий сік - 0,9-2
слина – 5,6-7,9
сеча – 5-6,5
відхилення значення рН від норми приводить до виникнення патологічних станів організму, оскільки іони гідрогену і гідроксиду визначають структуру.
6. Добуток розчинності. Умови утворення та розчинення осадів.
Розчинність -це здатність речовини розчинятися у тому чи іншому розчиннику. Вона тим більша, чим сильніша взаємодія між компонентами розчину.
Добуток розчинності (ДР) — добуток рівноважних концентрацій іонів у насиченому розчині малорозчинного сильного електроліту. Показники ступеня для концентрацій, які входять у ДР, дорівнюють стехіометричним коефіцієнтам у рівнянні дисоціації електроліту. Для кожного електроліту при певній температурі і в певному розчиннику ДР є стала величина. Сталість ДР виводять із закону діючих мас згідно з рівновагою тверда фаза її насичений розчин. При цьому припускають, що у розчині електроліт знаходиться тільки у вигляді іонів. Значення ДР малорозчинних у воді сполук визначають за допомогою електрохімічних методів: шляхом вимірювання електрорушійної сили або за електропровідністю насичених розчинів. У таблицях значення ДР наводять при температурах 18–25 °С. З ДР визначають умови утворення і розчинення осаду. Якщо добуток рівноважних концентрацій іонів у насиченому розчині дорівнює ДР малорозчинного електроліту, то гетерогенна система перебуває у стані рівноваги: Малорозчинний електроліт випадає в осад, коли добуток рівноважних концентрацій іонів більший за значення ДР.Оскільки ДР при певній температурі є сталою величиною, то підвищення концентрації одного з іонів, на які дисоціює сполука, призводить до зменшення концентрації іншого.
Константа Крозч . є добутком розчинності сполуки іонного типу
К роз= 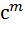 (
( )*
)* 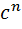 (
( )
)
Наприклад: Крозч.(AgCl) = с(Ag+) ∙ с(Сl-)
Розчинення хімічних сполук у воді є складним фізико-хімічним процесом, при якому відбувається розрив міжмолекулярних та іонних зв’язків кристалічної решітки і перехід речовини в розчин у вигляді окремих молекул або іонів, що рівномірно розподіляються серед молекул розчинника. Для такого руйнування кристалічної решітки треба затратити досить велику енергію. Ця енергія вивільняється звичайно в процесі гідратації – хімічної взаємодії розчинюваної речовини з водою. Отже, здатність речовини розчинятися залежить від співвідношення двох величин: енергії кристалічної решітки і енергії гідратації. Коли величина енергії гідратації більша за величину енергії кристалічної решітки речовини, остання повинна бути легкорозчинною. При оберненому співвідношенні цих величин речовина важкорозчинна.
Залежність між хімічним складом речовин і їх розчинністю описують певними емпіричними правилами, які мають статистичний характер:
1. Неорганічні й органічні кислоти в більшості випадків добре розчиняються. Винятком є H2SiO3, H2SnO3, HSbO3.
2. Усі основи є важкорозчинні, за винятком лугів: KOH, NaOH, Ba(OH)2, Sr(OH)2.
3. За розчинністю солі поділяються на дві великі групи.
1) Солі сильних кислот добре розчиняються. Винятком є BaSO4, SrSO4, PbSO4, PbCl2, PbBr2, PbI2, AgCl, AgBr, AgI, Hg2Cl2, Hg2Cl2, Hg2Br2, Hg2I2.
2) Солі слабких кислот розчиняються погано, за винятком солей Na+, K+, а також солей ацетатної і нітратної кислот.
Отже, розчинність сполук, як було з’ясовано, зумовлена їхнім хімічним складом. Але на розчинність значною мірою впливають зовнішні умови проведення реакції, зокрема концентрація і температура.
Розчинність переважної кількості солей збільшується з підвищенням температури
Більшою мірою розчинність залежить від концентраційних співвідношень іонів у розчині.
При утворенні в розчині осаду важкорозчинного сильного електроліту між осадом і розчином встановлюється хімічна рівновага. Невелика частина молекул речовини постійно переходить з осаду в розчин, розпадаючись на іони. При цьому одночасно з розчину в осад переходять з розчину інші аналогічні молекули. Ці рівноважні процеси характеризуються константою утворення осаду.
Для розчинення осаду необхідно, щоб його іонний добуток став меншим константи добутку розчинності.
Зменшення концентрації іонів може бути здійснено наступними способами:
 2. зв’язуванням іонів осаду в малодисоці-йовану сполуку, яка добре розчинна у воді
2. зв’язуванням іонів осаду в малодисоці-йовану сполуку, яка добре розчинна у воді
Co(OH)Cl + HCl = CoCl2 + H2O
3. переведення іонів осаду в сполуку, яка розкладається з виділенням газів

 ZnS + 2HCl = ZnCl2 + H2S
ZnS + 2HCl = ZnCl2 + H2S
 3. зв’язуванням іонів осаду в комплекс
3. зв’язуванням іонів осаду в комплекс
AgCl + 2NH3 = [Ag(NH3)2]Cl
4. окисненням або відновленням іонів осаду в іншу сполуку
 MnO(OH)2 + H2C2O4 + H2SO4 =
MnO(OH)2 + H2C2O4 + H2SO4 =
MnSO4 + 2CO2 + 3H2O
 2018-01-21
2018-01-21 1644
1644








