Экзотермическая реакция (от экзо... вне и греч. thérmó — тепло, жар), химическая реакция, сопровождающаяся выделением теплоты. Экзотермическая реакция являются, например, горение, нейтрализация, большинство реакций образования химических соединений из простых веществ. Количество выделяющейся при экзотермическая реакция теплоты зависит от массы реагентов и их природы, агрегатного состояния исходных веществ и продуктов взаимодействия, типа реакции и условий её осуществления (температуры, давления и др.). По тепловому эффекту экзотермическая реакция противоположны эндотермическим реакциям.
Эндотермическая реакция (от эндо... внутри и греч. thérme — тепло, жар), химическая реакция, сопровождающаяся поглощением теплоты. К эндотермическим реакциям относятся диссоциация (в частности, разложение молекул на свободные атомы), восстановление металлов из руд, фотосинтез в растениях, образование некоторых соединений из простых веществ.
Закон Гесса — Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
|
|
|
Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данноехимическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы). Например, окислениеглюкозы в организме осуществляется по очень сложному многостадийному механизму, однако суммарный тепловой эффект всех стадий данного процесса равен теплоте сгорания глюкозы.
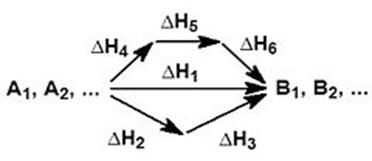
На рисунке приведено схематическое изображение некоторого обобщенного химического процесса превращения исходных веществ А1, А2… в продукты реакции В1, В2…, который может быть осуществлен различными путями в одну, две или три стадии, каждая из которых сопровождается тепловым эффектом ΔHi. Согласно закону Гесса, тепловые эффекты всех этих реакций связаны следующим соотношением:
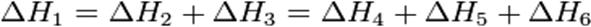
Закон открыт русским химиком Г. И. Гессом в 1840 г.; он является частным случаем первого начала термодинамикиприменительно к химическим реакциям. Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые эффекты самых разнообразных химических процессов; для этого обычно используют ряд следствий из него.
Скорость реакции и факторы, влияющие на нее. Гомогенные и гетерогенные реакции. Закон действующих масс. Константа скорости реакции. Порядок и молекулярность реакции. Правило Вант-Гоффа
|
|
|
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение умножается на −1.
Например, для реакции:A+B=C+Dвыражение для скорости будет выглядеть так 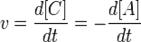 Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы: природа реагирующих веществ, наличие катализатора, температура (правило Вант-Гоффа), давление, площадь поверхности реагирующих веществ. ГОМОГЕННЫЕ РЕАКЦИИ - хим. р-ции, протекающие полностью в одной фазе. Примеры гомогенных реакций в газовой фазе: термич. Разложение оксида азота 2N2O5 -> 4NO2 + О2; горение этана 2С2Н6 + 7О2 -> 4СО2 + 6Н2О; образование озона в земной атмосфере ЗО2 -> 2О3.
Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы: природа реагирующих веществ, наличие катализатора, температура (правило Вант-Гоффа), давление, площадь поверхности реагирующих веществ. ГОМОГЕННЫЕ РЕАКЦИИ - хим. р-ции, протекающие полностью в одной фазе. Примеры гомогенных реакций в газовой фазе: термич. Разложение оксида азота 2N2O5 -> 4NO2 + О2; горение этана 2С2Н6 + 7О2 -> 4СО2 + 6Н2О; образование озона в земной атмосфере ЗО2 -> 2О3.
ГЕТЕРОГЕННЫЕ РЕАКЦИИ, хим. р-ции с участием вещ-в, находящихся в разл. фазах и составляющих в совокупности гетерог. систему. Типичные гетерогенные реакции: термич. разложение солей с образованием газообразных и твердых продуктов (напр., СаСО3 ->СаО+ СО2)
Восстановление оксидов металлов водородом или углеродом (напр., РbО+С>Рb+СО), растворение металлов в кислотах (напр.,Zn+H2SO4 ->ZnSO4 +Н2). Закон действующих масс – скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.Для одностадийной гомогенной реакции типа А+В = продукты реакции. Этот закон выражается уравнением:
v 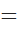 k*CA*CB, где v - скорость реакции, CA и CB – концентрации веществ А и В, моль/л, k- коэффициент пропорциональности, называемый константой скорости реакции. Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1 моль/л или их произведение равно единице. Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации. Молекулярность элементарной реакции — число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.
k*CA*CB, где v - скорость реакции, CA и CB – концентрации веществ А и В, моль/л, k- коэффициент пропорциональности, называемый константой скорости реакции. Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1 моль/л или их произведение равно единице. Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации. Молекулярность элементарной реакции — число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.
Мономолекулярные реакции — реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.) Бимолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных) Тримолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении трех частиц. Реакции с молекулярностью более трёх неизвестны.
Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции. Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два—четыре раза.
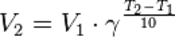 ,где
,где 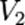 — скорость реакции при температуре
— скорость реакции при температуре 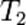 ,
, 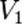 — скорость реакции при температуре
— скорость реакции при температуре 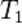 ,
, 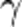 — температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
— температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
 2018-01-21
2018-01-21 8062
8062
