В растворе малорастворимого сильного электролита устанавливается равновесие между осадком (твердой фазой) электролита и ионами электролита в растворе, например: BaSO4(осадок) <=> Ba2+ (раствор) + SO42- (раствор)
Поскольку в растворах электролитов состояние ионов определяется их активностями, то константа равновесия последнего процесса выразится следующим уравнением: K = aBa2+ · aSO42- / aBaSO4
Так как активность твердого сульфата бария, есть величина постоянная, то и произведение активностей ионов также представляет собой постоянную величину.
Произведение активностей ионов малорастворимого электролита, содержащихся в его насыщенном растворе, есть величина постоянная при данной температуре и называется произведением растворимости (ПР). Для вещества состава AnBm произведение растворимости вычисляется по формуле:
ПР = (aAz+)n · (aBx-)m, где:
aAz+ - коэффициент активности иона Az+;
aBx- - коэффициент активности иона Bx-.
Если электролит очень мало растворим, то ионная сила его насыщенного раствора близка к нулю, а коэффициенты активности ионов мало отличаются от единицы. В подобных случаях произведение активностей ионов в выражении для вычисления ПР можно заменить произведением их концентраций и формула расчета произведения растворимости для вещества состава AnBm может быть записана в виде:
|
|
|
ПР = [Az+]n · [Bx-]m, где:
[Az+] - концентрация иона Az+;
[Bx-] - концентрация иона Bx-.
При увеличении концентрации одного из ионов электролита в его насыщенном растворе (например, путем введения другого электролита, содержащего тот же ион) произведение концентраций ионов электролита становится больше ПР. При этом равновесие между твердой фазой и раствором смещается в сторону образования осадка. Таким образом, условием образования осадка является превышение произведения концентраций ионов малорастворимого электролита над его произведением растворимости. В результате образования осадка концентрация другого иона, входящего в состав электролита, тоже изменяется. Устанавливается новое равновесие, при котором произведение концентраций ионов электролита вновь становится равным ПР. Напротив, растворение осадка малорастворимого электролита происходит при условии, что произведение концентраций его ионов меньше значения ПР. Добавление в раствор электролита, не имеющего общих ионов с малорастворимым, приводит к увеличению растворимости малорастворимого электролита за счет увеличения ионой силы раствора (так называемый солевой эффект).
25Константа воды. Водородный показатель (pH).
Водородный показатель (рН) величина, характеризующая активность или концентрацию ионов водорода в растворах. Водородный показатель численно равен отрицательному десятичному логарифму активности или концентрации ионов водорода, выраженной в молях на литр:
pH=-lg[ H+ ]
В воде концентрация ионов водорода определяется электролитической диссоциацией воды по уравнению
H2O=H++OH-
Константа диссоциации при 22° С составляет
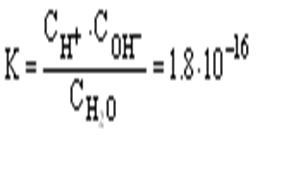
|
|
|
Пренебрегая незначительной долей распавшихся молекул, можно концентрацию недиссоциированной части воды принять равной обшей концентрации воды, которая составляет: С[H2O ]=1000/18=55,55моль/л.
Тогда: C[ H+ ] ·C[ OH- ]=K·C[H2O]=1,8·10-16·55,55=10-14
Для воды и ее растворов произведение концентраций ионов Н+ и ОН- величина постоянная при данной температуре. Она называется ионным произведением воды КВ и при 25° С составляет 10-14.
Постоянство ионного произведения воды дает возможность вычислить концентрацию ионов H+если известна концентрация ионов OH-
и наоборот: 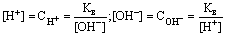 .
.
Понятия кислая, нейтральная и щелочная среда приобретают количественный смысл.
В случае, если [ H+ ] =[ OH- ]эти концентрации (каждая из них) равны 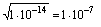 моль/л, т.е [ H+ ] =[ OH-]=10-7моль/л и среда нейтральная, в этих растворах
моль/л, т.е [ H+ ] =[ OH-]=10-7моль/л и среда нейтральная, в этих растворах
pH=-lg[ H+ ]=7 и рОН=-lg[ OH-]=7
Если [ H+ ]>10-7моль/л, [ OH-]<10-7моль/л -среда кислая; рН<7.
Если [ H+ ]<10-7 моль/л, [ OH-]>10-7моль/л -среда щелочная; рН>7.
В любом водном растворе рН + рОН =14, где рОН=-lg[ OH-]
Величина рН имеет большое значение для биохимических процессов, для различных производственных процессов, при изучении свойств природных вод и возможности их применения и т.д.
Буферные растворы
Буферные растворы — растворы с определённой устойчивой концентрацией водородных ионов; смесь слабой кислоты и её соли(напр., СН3СООН и CH3COONa) или слабого основания и его соли (напр., NH3 и NH4CI). Величина рН буферного раствора мало изменяется при добавлении небольших количеств свободной сильной кислоты или щёлочи, при разбавлении или концентрировании. Буферные растворы широко используют в различных химических исследованиях.
Буферные растворы имеют большое значение для протекания процессов в живых организмах. Например, в крови постоянство водородного показателя рН поддерживается буферными смесями, состоящими из карбонатов и фосфатов. Известно большое число буферных растворов (ацетатно-аммиачный буферный раствор,фосфатный буферный раствор, боратный буферный раствор, формиатный буферный раствор и др.).
Значение pH буферного раствора можно рассчитать по формуле:  , где
, где  это отрицательный десятичный логарифм от константы диссоциации кислоты
это отрицательный десятичный логарифм от константы диссоциации кислоты  .
.
По сути  .
.
Емкость кислотно-основного буферного раствора соответствует числу эквивалентов сильной к-ты или сильного основания, к-рое необходимо добавить к 1 л р-ра, чтобы изменить его рН на единицу. Буферная емкость возрастает при увеличении начальныхконцентраций его компонентов и максимальна при их равенстве. Буферные св-ва проявляются очень слабо, если концентрация одного компонента в 10 раз и более отличается от концентрации другого. Поэтому буферный раствор часто готовят смешением р-ров равнойконцентрации обоих компонентов либо прибавлением к р-ру одного компонента соответствующего кол-ва реагента, приводящего к образованию равной концентрации сопряженной формы.
27) Гидролиз солей: типы, константа и степень гидролиза.
Гидролиз солей -это взаимодействие ионов соли с водой, приводящее к образованию слабого электролита. Различают три вида гидролиза солей:
1)гидролиз по аниону. Соль образована сильным основанием и слабой кислотой.(Например СH3COONa)
Диссоциация соли(сильный электролит): СH3COONa→СH3COO- +Na+
Диссоциация воды:H2O↔H++OH-
Сумируя данные уравнения, получаем уравнение гидролиза соли в ионном виде:
CH3COO- +H2O↔CH3COOH+OH-
Данное уравнение показывает, что идёт накопление гидроксид-ионов, а потому раствор приобретает щелочную реакцию.
|
|
|
2)Гидролиз по катиону. Соль образована сильной кислотой и слабым онованием.(Например NH4CL):
NH4CL→NH4++CL-
H2O↔H++OH-
NH4++H2O↔NH4OH+H+
В данном случае реакция раствора кислая, т.к. происходит накопление ионовH+.
3)Гидролиз по катиону и аниону. Соль образована слабыми кислотой и основанием.(Например СH3COONH4):
СH3COONH4→СH3COO -+NH4+
H2O↔H++OH-
СH3COONH4+H20↔СH3COOH+NH4OH
В данном случае степень гидролиза солей не зависит от разбавления и кислотность водных растворов солей может принимать различные значения.
Количественно реакция гидролиза характеризуется:
1)Степенью гидролиза(h)-отношением числа гидролизовавшихся молекул соли к исходному числу молекул соли, измеряется в процентах или в долях. Изменяется с температурой, зависит от концентрации солевого раствора.
2)Константой гидролиза(Кг)- константа равновесия обратимой реакции. Зависит от температуры, но не зависит от концентрации раствора.
28)Окислительно-восстановительные реакции: степень окисления, окислитель и восстановитель (важнейшие окислители и восстановители), типы окислительно-восстановительных реакций
Окислит.-восстан. реакции - реакции, протекающие с изменением степени окисления атомов. Под степенью окисления понимают условный заряд атома в молекуле, вычисленный исходя из предположения, что молекула состоит только из ионов.
Окисление- процесс отдачи электронов, степень окисления при этом повышается.
Восстановление- процесс присоединения электронов, степень окисления при этом повышается.
Атомы, молекулы или ионы отдающие электроны, называются восстановителями. Восстановители во время реакции окисляются.
Атомы, молекулы или ионы принимающие электроны, называются окислителями. Окислители во время реакции восстанавливаются.
Реакции окисления и восстановления всегда протекают как единый процесс. В этих реакциях число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем.
Элементы в высших степенях окисления проявляют только окислительные свойства, в низших-только восстановительные, а в промежуточных-окислительно-восстановительную двойственность.
|
|
|
Типы ОВР:
1)Межмолекулярные. В межмолекулярных (межатомных) реакциях окислительные функции выполняют одни вещества, а восстановительные – другие. Например, в реакции H2S + Cl2 = S + 2HCl электроны от восстановителя – молекулы сероводорода – переходят к окислителю – молекуле Cl2.
2)Внутримолекулярные. В реакциях внутримолекулярного окисления-восстановления одна часть молекулы – окислитель, другая – восстановитель. Простейшими примерами могут служить реакции термического разложения вещества. Примеры:
2H2O → 2H2 + O2
2KClO3 → 2KCl + 3O2
NH4NO3 (t°) → N2O + 2H2O
3)Диспропорционирования
Реакции диспропорционирования (самоокисления-самовосстановления) протекают с одновременным уменьшением и увеличением степени окисления атомов одного и того же элемента. Они характерны для соединений или простых веществ, состоящих из промежуточных степеней окисления данного элемента. Примеры:
NH4NO3 → N2O + 2H2O
CL2 + H2O → HCL + HCLO
3KBrO → KBrO3 + 2KBr
Важнейшие восстановители и окислители
Восстановители
Металлы, водород, уголь, Окись углерода (II) (CO).Сероводород (H2S);оксид серы (IV) (SO2);сернистая кислота H2SO3 и ее соли, Галогеноводородные кислоты и их соли. Катионы металлов в низших степенях окисления: SnCl2, FeCl2, MnSO4, Cr2(SO4)3.
Азотистая кислота HNO2;аммиак NH3;гидразин NH2NH2;оксид азота(II) (NO).
Катод при электролизе.
Окислители
Галогены. Перманганат калия(KMnO4); манганат калия (K2MnO4); оксид марганца (IV) (MnO2). Дихромат калия (K2Cr2O7); хромат калия (K2CrO4). Азотная кислота (HNO3). Серная кислота (H2SO4) конц. Оксид меди(II) (CuO); оксид свинца(IV) (PbO2); оксид серебра (Ag2O); пероксид водорода (H2O2). Хлорид железа(III) (FeCl3). Бертоллетова соль (KClO3). Анод при электролизе.
 2018-01-21
2018-01-21 6423
6423
