Диссоциация -распад на ионы.
1.Электролиты в воде распадаются на ионы, т.е. протекает электролитическая диссоциация.
2.Под действием внешнего электрического тока происходит их направленное движение.
Диссоциация -обратимый процесс,на ряду с распадом может быть ассоциация(объединение ионов в малекулы) В растворах диссоциация происходит за счёт нагревания,что усиливает колебания ионов кристаллической решётки.В растворе воды молекулы разрушают ионную кристаллическую решётку.
Часто диссоциация протекает ступенчато:
NaHSO4àNa(^+)+HSO4(^-)àH(^+)+SO4(^-2)
Степень диссоциации α=(n/N)*100% ---Отношение числа растворившихся молекул к общему числу молекул в растворе
Сильные электролиты α>30%/средние- 3%<=α<=30%/ слабые- α<3%
Слабые электролиты: *органические,* ряд неорганических кислот(H2S,H2CO3,H2SO4,HNO2,H3PO4),*слабые основания(NH4OH),*Гидроксиды металлов(кроме 1-ой и 2-ой группы)
Сильные электролиты - *Практически все растворимые соли,*ряд неорганических кислот(HBr,HJ,HNO3,H2SO4,HClO4,HClO3),*Гидроксиды металлов 1-ой А и 2-ой А групп(LiOH,KOH,NaOH)
|
|
|
В растворах сильных электролитов наблюдается высокая концентрация ионов,в результате чего они взаимодействуют,связываются,при этом с уменьшением заряженных частиц. изотонический коэффициент i (коэффициент Вант-Гоффа) – число, показывающее во сколько раз общее количество частиц в растворе больше, чем количество молекул электролита
(N) 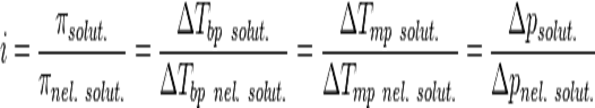
где solut. — данный раствор, nel. solut. — раствор неэлектролита той же концентрации, Tbp — температура кипения, а Tmp — температура плавления (замерзания).
Теория электролитической диссоциации Аррениуса -согласно этой теории, при растворении в воде электролиты распадаются (диссоциируют) на положительные (катионы) и отрицательные (анионы) заряженные ионы. Аррениус объяснил, что лишь часть электролита диссоциирует и ввел понятие степени диссоциации электролита- отношение числа его молекул, распавшихся в данном растворе на ионы, к общему числу его молекул в растворе.
 2018-01-21
2018-01-21 972
972








