В процессах, происходящих в природе, действуют 2 конкурирующие тенденции: 1) стремление системы перейти в состояние с наименьшей энергией, т. е. с понижением энтальпии и 2) стремление системы перейти в состояние с максимальной степенью разупорядоченности системы, т.е. повысить энтропию.
Если в процессе степень беспорядка не изменяется, то направление процесса определяется изменением энтальпии и процесс происходит самопроизвольно в направлении уменьшения этальпии. 
Если процесс происходит без изменения энергетического запаса  , то фактором, определяющим направление реакции, является энтропия и процесс происходит самопроизвольно в сторону увеличения энтропии
, то фактором, определяющим направление реакции, является энтропия и процесс происходит самопроизвольно в сторону увеличения энтропии  .
.
Если одновременно изменяется энтальпия и энтропия, то направление самопроизвольного процесса протекает в том направлении, в котором общая суммарная движущая сила системы будет уменьшаться.
Для реакции, протекающей при t=const, p=const такой движущей силой является изобарно – изотермический потенциал (G) открыл ученый Гиббс. Этот потенциал связан с энтальпией, энтрапией и температурой.
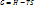 ;
; 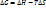
По знаку изменения изобарно – изотермического потенциала можно судить о направлении процесса.
Если  ,то реакция протекает самопроизвольно в прямом направлении.
,то реакция протекает самопроизвольно в прямом направлении.
Если ∆ G>0, то реакция невозможна, либо возможен обратный процесс.
Если ∆ G=0, то термодинамически возможны как прямая так и обратная реакция. Отсутствие изменения энергии Гиббса является термодинамическим условием установления химического равновесия.
Влияние Tемпературы на  определяется знаком и величиной
определяется знаком и величиной  S.
S.
Если реакция протекает с увеличением энтрапии∆S>0 и повышением Т, то это приводит к увеличению отрицательного значения ∆G, что способствует протеканию процесса.
Для реакции, протекающей с уменьшением  S, повышение Т препятствует протеканию процесса и
S, повышение Т препятствует протеканию процесса и  приобретает положительное значение.
приобретает положительное значение.
Если в процессе энтрапия  S=0, то Т не влияет на значение
S=0, то Т не влияет на значение  G.
G.
∆H<0, ∆S<0 => реакция возможна при низких температурах.
∆H>0, ∆S>0 => реакция возможна при высоких температурах.
Если ∆H<0, ∆S>0 =>всегда ∆G<0, это значит экзотермические реакции с увеличением энтрапии возможны при любых температурах.
Если ∆H>0, ∆S<0=> всегда ∆G>0Эндотермические реакции протекают только в обратном направлении.
 2018-01-21
2018-01-21 745
745








