Предположение о том, что экзотермические соединения являются устойчивыми, было введено в химию более 100 лет назад. Был сформулирован принцип, согласно которому химические процессы осуществляются только в том случае, если они сопровождаются выделением теплоты. Наряду с экзотермическими, известно несколько типов реакций, протекающих самопроизвольно с эндотермическим эффектом. Рассмотрим систему, состоящую из двух газов, находящихся при одной температуре, в каком- то объеме, разделенных перегородкой. После удаления перегородки происходит смешение газа по всему объему расходятся молекулы. Состояние смешения по всему объему более вероятно, чем они находятся в своих частях сосуда, т.к. оно разупорядочено. Процесс смешения газов, не реагирующих между собой, протекает самопроизвольно и без изменения энергии. Обратный процесс, т.е. разделение газа самопроизвольно не произойдет. Движущей слой смешения газов являются силы, стремящиеся перевести систему в более вероятное и разупорядоченное состояние.
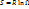 где Ω- вероятность системы, R – газовая постоянная
где Ω- вероятность системы, R – газовая постоянная
Энтропия – логарифмическое выражение вероятности существования веществ и их состояний. Она является также как и энтальпия, финкцией состояния системы, т. е. она изменяется переходя из одного состояния в другое. Величина энтропии зависит от агрегатного состояния вещества.
ΔS = ΔSконеч – ΔSначальное.
Если процессы происходят без изменения энтальпииΔН=0, то реакция протекает самопроизвольно ΔS>0. Знак изменения энтропии реакции можно предсказать взависимости от состояния участвующих в реакции веществ. Если реакция вытекает безизменение объема, то предсказать изменение энтропии невозможно в этом случаи нужно использовать данные справочника и проводить вычисления энтропии.
∆S<0 => беспорядок в системе уменьшается и система стремится к упорядоченности.
∆S>0 => беспорядок в системе увеличивается и система стремится к хаотичности.
∆H<0, ∆S<0 => реакция возможна при низких температурах.
∆H>0, ∆S>0 => реакция возможна при высоких температурах.
∆H<0, ∆S>0 => реакция возможна при любых температурах.
∆H>0, ∆S<0 => реакция невозможна, либо возможен обратный процесс
 2018-01-21
2018-01-21 800
800








