Любая термодинамически разрешенная химическая реакция должна быть обусловлена определенными факторами, кот позволяют определять скорость и механизм ее протекания. Эти понятия составляют основу химической кинетики. Она позволяет количественно описать ход химического процесса во времени при постоянной температуре в зависимости от концентрации реагирующих веществ.
Скорость гомогеннойреакциии определяется по изменению любого из реагрирующих веществ в единицу времени.
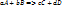
Скорость для данного процесса может быть определена или по убыли концентрации вещества А или В; или по приращению концентрации вещества С или D.
Поскольку все вещества взаимодействуют в строго эквивалентных соотношениях, то скорость может быть определена через изменение концентрации любого реагента данной реакции, это значит что при фиксированной Т скорость гомогенной реакции, определяется убылью или приращением концентрации любого реагента за бесконечно малое время.
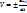 скорость химической реакции определяется по изменению какого-то компонента в единицу времени.
скорость химической реакции определяется по изменению какого-то компонента в единицу времени.
+ изменение концентрации продуктов реакции всегда увеличивается
- изменение концентрации исходных веществ всегда уменьшается
 2018-01-21
2018-01-21 367
367








