Химическая кинетика — это раздел химии, изучающий скорости реакций и влияние на них различных факторов.
В гомогенном (однофазном) процессе реакция протекает во всём объёме системы и её скорость характеризуется изменением концентрации любого реагента, или любого продукта в единицу времени. Различают среднюю скорость v ср = ±ΔС/Δt, где ΔC – изменение молярной концентрации за период времени Δt, и истинную скорость в момент времени t, представляющую собой производную от концентрации по времени: v = ±dС/dt.
Скорость каждой конкретной реакции в отсутствие катализатора зависит от концентраций реагентов и от температуры. Скорость гетерогенных реакций, протекающих на межфазной поверхности раздела, зависит также от величины этой поверхности.
Влияние концентраций реагентов на скорость реакций устанавливается законом действующих масс: при фиксированной температуре скорость реакции пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам.
Для реакции аА + bВ = сС + dD математическое выражение закона действующих масс, называемое кинетическим уравнением реакции, записывается: v = kСАаСBb, где k — коэффициент пропорциональности, носящий название константы скорости, СA и СB — молярные концентрации реагентов, а и b — их стехиометрические коэффициенты. Сумма показателей степеней в кинетическом уравнении называется порядком реакции. В многостадийных реакциях порядок реакции может быть дробным, но не более 3.
Вкинетических уравнениях реакций концентрации веществ в конденсированном состоянии ввиду их неизменности не указываются. Эти постоянные концентрации в качестве составных частей входят в константу скорости.
Механизмом реакции называют совокупность стадий химической реакции, в результате которых исходные вещества превращаются в конечные. Реакции могут быть одностадийными и многостадийными. Скорость реакции определяется скоростью самой медленной ее стадии (лимитирующей стадии).
Различают гомогенные и гетерогенные химические реакции. Реакции, протекающие в однофазной (однородной) системе, например, жидкой или газообразной, называются гомогенными. Такие реакции протекают во всем объеме системы. Реакции, протекающие в многофазных системах (состоящих из двух или более фаз, например, газообразной и твердой фазы) называются гетерогенными. Такие реакции протекают только на поверхности раздела фаз. Скорость гетерогенной реакции определяется изменением концентрации реагирующих веществ на единице поверхности в единицу времени.
Молекулярностью реакции называется число частиц, участвующих в элементарном акте химического взаимодействия. В реальных реакциях молекулярность может быть равна 1, 2, 3. В простых реакциях, протекающих в одну стадию, порядок совпадает с молекулярностью. Закон действующих масс справедлив для простых реакций. В случае сложных реакций, протекающих в несколько стадий, закон применим к любой отдельной реакции, но не к их сумме.
Зависимость скорости реакции от температуры объясняется тем, что, как уже отмечалось, скорость реакции зависит от числа соударений участвующих в реакции частиц (атомов, молекул, ионов). Но не все соударения приводят к химическому взаимодействию. Для того чтобы реакция произошла, частицы должны обладать некоторым избыточным количеством энергии (по сравнению со средней величиной), называемым энергией активации (EА). Чем выше температура, тем больше частиц имеет энергию, большую или равную EА. Поэтому скорость реакции увеличивается с повышением температуры. Константа скорости химической реакции определяется числом эффективных столкновений, т.е. числом активных молекул, способных вступить в химическую реакцию. Зависимость константы скорости реакции от температуры и энергии активации выражается уравнением Аррениуса:
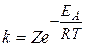 ,
,
где k – константа скорости реакции, Z – постоянная, называемая стерическим фактором и зависящая от числа столкновений, приводящих к реакции; е – основание натурального логарифма (е = 2,7183...); 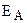 – энергия активации, Дж/моль; R – газовая постоянная (R = 8,314 Дж/К·моль), Т – температура, К.
– энергия активации, Дж/моль; R – газовая постоянная (R = 8,314 Дж/К·моль), Т – температура, К.
Химическое равновесие устанавливается в обратимых реакциях — в реакциях, которые могут протекать как в прямом, так и в обратном направлении. Если реакция аА + bВ ↔ cC + dD) обратима, это означает, что реагенты А и В способны превращаться в продукты С и D (прямая реакция), а продукты С и D в свою очередь могут, реагируя между собой, вновь образовывать исходные вещества А и В (обратная реакция).
Термодинамическим условием химического равновесия является неизменность энергии Гиббса реакции, т.е. r G = 0, а кинетическим условием равновесия — равенство скоростей прямой (v1) и обратной (v2) реакции: v1 = v2.
Так как в состоянии химического равновесия и прямая, и обратная реакции протекают с одинаковыми скоростями, концентрации реагентов и продуктов во времени не изменяются. Эти не изменяющиеся во времени концентрации называются равновесными. Равновесные концентрации, в отличие от неравновесных, изменяющихся в ходе реакции, принято обозначать особым образом, а именно, формулой вещества, заключённой в квадратные скобки. Например, записи [Н2], [NН3] означают, что речь идёт о равновесных концентрациях водорода и аммиака.
При заданной температуре соотношение равновесных концентраций реагентов и продуктов есть величина постоянная и характерная для каждой реакции. Это соотношение количественно характеризуется величиной константы химического равновесия Кс, равной отношению произведения равновесных концентраций продуктов к произведению равновесных концентраций реагентов, возведённых в степени, равные их стехиометрическим коэффициентам.
Для обратимой реакции аА + bВ ↔ cС + dD выражение Кс имеет вид:
Кс = 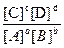 . Так же как в кинетических уравнениях реакций, в выражениях констант равновесия концентрации веществ в конденсированном состоянии, ввиду их постоянства, не записываются.
. Так же как в кинетических уравнениях реакций, в выражениях констант равновесия концентрации веществ в конденсированном состоянии, ввиду их постоянства, не записываются.
Для реакций с участием газов константа химического равновесия может быть выражена не только через равновесные концентрации, но и через равновесные парциальные давления газов. В этом случае символ константы равновесия "К" индексируется не символом концентрации "с", а символом давления "р".
В равновесном состоянии, характеризующимся равенством скоростей прямой и обратной реакции, система может находиться сколь угодно долго, если не происходит изменения условий. При изменении условий равенство скоростей v1 = v2 нарушается, одна из двух реакций начинает протекать с большей скоростью. Это выражают, говоря, что в системе происходит смещение (сдвиг) химического равновесия.
Если в результате изменения условий в системе с большей скоростью начинает протекать прямая реакция, т.е. v1 > v2, равновесие смещается в сторону прямой реакции — вправо и, наоборот, если скорость обратной реакции становится больше скорости прямой реакции, т.е. выполняется условие v 2 > v 1, происходит сдвиг равновесия в сторону обратной реакции — влево.
Сдвиг химического равновесия можно осуществить изменением концентраций реагентов или продуктов и изменением температуры, а для реакций с участием газов ещё и изменением давления. Направление смещения равновесия при таких изменениях условий определяется принципом Ле Шателье (принципом противодействия): если в равновесной системе изменить условия, в ней произойдёт сдвиг равновесия в сторону той реакции, которая противодействует произведённому изменению.
Задача 1. Для данной химической реакции напишите кинетическое уравнение и определите теоретический порядок реакции. Рассчитайте, как изменится скорость реакции при указанных изменениях условий протекания реакции: Fe2O3(тв) + 3CO(г) → 2Fe(тв) + 3CO2(г)
Во сколько раз изменится (увеличится или уменьшится) скорость реакции если:
а) увеличить давление в 2 раза;
б) увеличить объем реакционной смеси в 2 раза
в) повысить температуру на 40?С (γ = 2)
г) понизить температуру на 20?С (γ = 2)
Fe2O3 (тв) + 3CO(г) → 2Fe (тв) + 3CO2(г) – реакция гетерогенная (участвуют вещества в различающихся фазовых состояниях).
Кинетическое уравнение: υ1 = k · с3 (CO),
k – константа скорости. В кинетическое уравнение гетерогенных реакций входят только концентрации газов или растворенных в растворителе веществ.
Теоретический порядок реакции: 3 (cумма показателей степеней концентраций в кинетическом уравнении называется теоретическим порядком реакции).
Расчет изменения скорости реакции:
а) при увеличении давления в 2 раза: скрость реакции до увеличения давления описывается кинетическим уравнением:
υ1 = k · с3(CO), где с3 (CO) – начальная (исходная) концентрация оксида углерода (II).
При увеличении давления происходит и увеличение концентрации, т.е. если давление увеличить в 2 раза, то и концентрация увеличится в 2 раза, поэтому кинетическое уравнение реакции после изменения давления имеет следующий вид:
υ2 = k · (2с)3 (CO), где (2с)3 (CO) концентрация оксида углерода (II) после повышения давления в системе в 2 раза.
Изменение скорости реакции (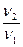 ):
):
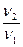 =
= 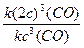 =
= 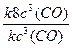 = 23 = 8 – скорость реакции возрастет в 8 раз.
= 23 = 8 – скорость реакции возрастет в 8 раз.
б) при увеличении объема реакционной смеси в 2 раза:
увеличение объема реакционной смеси в 2 раза приведет к уменьшению концентрации газа в 2 раза: υ1 = k · с3 (CO), где с3(CO) – начальная (исходная) концентрация оксида углерода (II).
υ2 = k 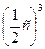 (CO), где
(CO), где 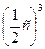 (CO) – концентрация оксида углерода (II) после увеличении объема реакционной смеси в 2 раза.
(CO) – концентрация оксида углерода (II) после увеличении объема реакционной смеси в 2 раза.
Изменение скорости реакции (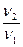 ):
):
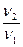 =
= 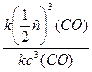 =
= 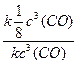 =
= 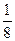 – скорость реакции уменьшится в 8 раз.
– скорость реакции уменьшится в 8 раз.
в) повышение температуры на 40°С (γ = 2):
При изменении температуры скорость реакции изменяется по правилу Вант-Гоффа:
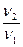 = γΔТ/10, где γ - температурный коэффициент реакции, ΔТ – изменение температуры (Т2 – Т1), υ1 – скорость реакции при температуре Т1, υ2 – скорость реакции при температуре Т2.
= γΔТ/10, где γ - температурный коэффициент реакции, ΔТ – изменение температуры (Т2 – Т1), υ1 – скорость реакции при температуре Т1, υ2 – скорость реакции при температуре Т2.
По данным условия задачи температура повышалась на 40°С, следовательно
ΔТ = Т2 – Т1 = 40,
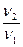 = 240/10 = 24 = 16 – скорость реакции возрастет в 16 раз.
= 240/10 = 24 = 16 – скорость реакции возрастет в 16 раз.
г) понижение температуры на 20°С (γ = 2):
При изменении температуры скорость реакции изменяется по правилу Вант-Гоффа:
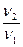 = γΔТ/10, где γ - температурный коэффициент реакции, ΔТ – изменение температуры (Т2 – Т1), υ1 – скорость реакции при температуре Т1, υ2 – скорость реакции при температуре Т2.
= γΔТ/10, где γ - температурный коэффициент реакции, ΔТ – изменение температуры (Т2 – Т1), υ1 – скорость реакции при температуре Т1, υ2 – скорость реакции при температуре Т2.
По данным условия задачи температура понижалась на 20°С,
следовательно ΔТ =Т1 – Т2 = -20,
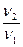 = 2-20/10 = 2-2 =
= 2-20/10 = 2-2 = 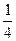 – скорость реакции уменьшится в 4 раза.
– скорость реакции уменьшится в 4 раза.
Задача 2. 1) Для обратимых реакций
CuO(тв) + CO(г) ↔ Cu(тв) + CO2(г) + QN2 (г) + O2 (г) ↔ 2NO (г) – Q, определите, в какую сторону сместится равновесие реакции, если:
а) увеличить температуру; б) уменьшить температуру
2) Для обратимых реакций:
C2H2(г) + 2H2(г) ↔ C2H6(г)
3S(тв) + H2О(г) ↔ 2H2S(г) + SО2(г)
С(тв) + О2(г) ↔ СО2(г), определите, в какую сторону сместится равновесие реакции, если:
а) увеличить давление; б) уменьшить давление
3) Для обратимой реакции:
Fe2O3(тв) + 3H2(г) ↔ 2Fe(тв) + 3H2O (г), определите, в какую сторону сместится равновесие реакции, если:
а) увеличить концентрацию Н2;
б) уменьшить концентрацию Н2;
в) увеличить концентрацию H2O
г) уменьшить концентрацию H2O
Направление, в котором смещается химическое равновесие, определяется по принципу Ле Шателье: если на равновесную систему оказывать внешнее воздействие, то равновесие смещается в сторону, противодействующую этому воздействию.
1) Увеличение температуры смещает равновесие в сторону эндотермической реакции (–Q), уменьшение температуры смещает равновесие в сторону экзотермической реакции (+ Q).
CuO(тв) + CO(г) ↔ Cu(тв) + CO2(г) + Q
В данном случае:
- прямая реакция CuO(тв) + CO(г) → Cu(тв) + CO2(г) + Q - экзотермическая,
- обратная реакция Cu(тв) + CO2(г) → CuO(тв) + CO(г) – Q - эндотермическая,
следовательно:
а) при увеличении температуры равновесие сместится в сторону обратной реакции (в сторону образования реагентов, влево (←)),
б) при уменьшении температуры равновесие сместится в сторону прямой реакции (в сторону образования продуктов, вправо (→)).
N2(г) + O2(г) ↔ 2NO (г) – Q
В данном случае:
прямая реакция N2(г) + O2(г) → 2NO(г) – Q – эндотермическая,
обратная реакция 2NO (г) → N2(г) + O2(г) + Q – экзотермическая,
следовательно:
а) при увеличении температуры равновесие сместится в сторону прямой реакции (в сторону образования продуктов, вправо(→))
б) при уменьшении температуры равновесие сместится в сторону обратной реакции (в сторону образования реагентов, влево(←)).
2) Увеличение давления смещает равновесие в сторону той реакции, в которой количество молекул газов уменьшается. Уменьшение давления смещает равновесие в сторону той реакции, в которой количество молекул газов увеличивается.
В системе C2H2(г) + 2H2(г) ↔ C2H6(г) прямая реакция (C2H2(г) + 2H2(г) → C2H6(г)) протекает с уменьшением количества молекул газов (из трех молекул исходных газов образуется одна молекула конечного продукта), а обратная реакция
(C2H6(г) → C2H2(г) + 2H2(г)) – протекает с увеличением числа молекул (из одной молекулы C2H6 образуется три новые (одна молекула C2H2 и две молекулы H2 ).
Следовательно:
а) увеличение давления смещает равновесие в сторону прямой реакции (в сторону образования продуктов, вправо(→));
б) уменьшение давления смещает равновесие в сторону обратной реакции (в сторону образования реагентов, влево(←)).
В системе 3S(тв) + H2О(г) ↔ 2H2S(г) + SО2(г) прямая реакция (3S(тв) + H2О(г) → 2H2S(г) + SО2(г)) протекает с увеличением количества молекул газов, а обратная (2H2S(г) + SО2(г) → 3S(тв) + H2О(г)) – протекает с уменьшением молекул газов (S(сера) – твердое вещество, количества молекул твердых веществ не учитываются).
Следовательно:
а) увеличение давления смещает равновесие в сторону обратной реакции (в сторону образования реагентов, влево (←));
б) уменьшение давления смещает равновесие в сторону прямой реакции (в сторону образования продуктов, вправо (→)).
В системе С(тв) + О2(г) ↔ СО2(г) количества молекул газов среди реагентов и среди продуктов равны (одна молекула О2 и одна молекула СО2(г)), следовательно изменение давления (увеличение или уменьшение) не повлияет на смещение химического равновесия в данной системе.
а) увеличение давления равновесие не смещает;
б) уменьшение давления равновесие не смещает.
3) а) увеличение концентрации реагентов смещает равновесие в сторону образования продуктов, следовательно:
для данной реакции Fe2O3(тв) + 3H2(г) ↔ 2Fe(тв) + 3H2O (г) увеличение концентрации реагента Н2 приведет к смещению равновесия в сторону прямой реакции (в сторону образования продуктов, вправо (→)).
б) уменьшение концентрации реагентов смещает равновесие в сторону образования реагентов, следовательно:
для данной реакции Fe2O3(тв) + 3H2(г) ↔ 2Fe(тв) + 3H2O (г) увеличение концентрации реагента Н2 приведет к смещению равновесия в сторону обратной реакции (в сторону образования реагентов, влево (←));
в) увеличение концентрации продуктов смещает равновесие в сторону образования реагентов, следовательно:
для данной реакции Fe2O3(тв) + 3H2(г) ↔ 2Fe(тв) + 3H2O (г) увеличение концентрации продукта Н2О приведет к смещению равновесия в сторону обратной реакции (в сторону образования реагентов, влево (←));
г) уменьшение концентрации продуктов смещает равновесие в сторону образования продуктов, следовательно:
для данной реакции Fe2O3(тв) + 3H2(г) ↔ 2Fe(тв) + 3H2O (г) уменьшение концентрации продукта Н2О приведет к смещению равновесия в сторону прямой реакции (в сторону образования продуктов, вправо (→)).
Задача 3. 1) Для обратимой реакции Fe2O3(тв) + 3CO(г) ↔ 2Fe(тв) + 3CO2(г) рассчитайте константу равновесия, если начальная концентрация СО равна 3 моль/л, к моменту наступления равновесия прореагировало 75% СО.
2) Для обратимой реакции S(тв) + H2(г) ↔ H2S(г) рассчитайте равновесные концентрации веществ, если начальная концентрация H2 равна 3 моль/л, а константа равновесия Кр = 15.
В) Для обратимой реакции 2NH3(г) ↔ 3H2(г) + N2(г) рассчитайте начальную концентрацию NH3 и константу равновесия данной реакции, если равновесные концентрации веществ равны [NH3] = 0,4 моль/л, [N2] = 1,2 моль/л, [Н2] = 3,6 моль/л.
Для решения данных задач удобно пользоваться таблицей следующего вида:
| Реагенты и продукты реакции | Реагенты | Продукты | ||
| Начальные концентрации | ||||
| Прореагировало к моменту наступления равновесия | ||||
| Равновесные концентрации |
1) Константа равновесия в гетерогенных реакциях зависит только от концентрации газов, поэтому количества твердых веществ (Fe2O3(тв) и Fe(тв)) не учитываются.
В строку начальных концентраций вписываем начальную концентрацию CO – 3 моль/л. Начальная концентрация CO2 равна нулю (это продукт реакции, которого в момент начала реакции еще не образовалось).
По условию к моменту наступления равновесия прореагировало 75% СО, т.е. 3 моль 0,75 = 2,25 моль.
В результате реакции образовалось 2,25 моль CO2, т.к. по уравнению реакции количество CO2 равно количеству CO.
После реакции останется следующие количество CO:
Снач - Спрореаг = 3 моль – 2,25 моль = 0,75 моль.
Таким образом, равновесные концентрации будут равны: [CO] = 0,75 моль/л [CO2] = 2,25 моль/л
| Реагенты и продукты реакции | Реагенты | Продукты | ||
| Fe2O3(тв) | 3CO(г) | 2Fe(тв) | 3CO2(г) | |
| Начальные концентрации | – | 3 | – | – |
| Прореагировало к моменту наступления равновесия | – | 2,25 | – | 2,25 |
| Равновесные концентрации | – | 0,75 | – | 2,25 |
Рассчитываем константу химического равновесия (в соответствии с Законом действующих масс: в состоянии химического равновесия при определенной температуре произведение концентраций продуктов реакции в степенях, показатели которых равны соответствующим коэффициентам в стехиометрическом уравнении реакции, деленное на аналогичное произведение концентраций реагентов в соответствующих степенях, представляет собой постоянную величину)
Кр = 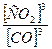 =
= 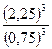 =27
=27
2) Составляем таблицу по уравнению реакции:
| Реагенты и продукты реакции | Реагенты | Продукты | |
| S(тв) | H2(г) | H2S(г) | |
| Начальные концентрации | – | 3 | 0 |
| Прореагировало к моменту наступления равновесия | – | х | х |
| Равновесные концентрации | – | 3-х | х |
В гетерогенных реакциях учитываются только концентрации газов.
Начальная концентрация H2 равна по условию 3 моль/л. Начальная концентрация H2S равна нулю (это продукт реакции, которого в момент начала реакции еще не образовалось).
Пусть образоваллось х моль H2. В этом случае концентрация H2S также будет равна х моль (т.к. по уравнению реакции их соотношение 1:1). Равновесная концентрация H2 рассчитывается:
Сравн = Снач – Спрореаг = (3 – х) моль, а равновесная концентрация H2S: Сравн =
= Снач + Спрореаг = 0 + х = х моль.
Выражение для константы равновесия данной реакции имеет следующий вид:
Кр = 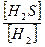 , подставляя известные данные, получим уравнение:
, подставляя известные данные, получим уравнение:
15 = 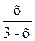 , отсюда х = 45-15х;
, отсюда х = 45-15х;
16х = 45; х = 2,8
Таким образом, равновесная концентрация H2S:
[H2S] = х = 2,8моль/л
Равновесная концентрация H2:
[H2] = 3-х = 3 - 2,8 = 0,2 моль/л
3) Составляем таблицу по уравнению реакции:
| Реагенты и продукты реакции | Реагенты | Продукты | |
| 2NH3(г) | 3H2(г) | N2(г) | |
| Начальные концентрации | 2,8 | 0 | 0 |
| Прореагировало к моменту наступления равновесия | 2,4 | 3,6 | 1,2 |
| Равновесные концентрации | 0,4 | 3,6 | 1,2 |
В строку равновесных концентраций записываем данные в задаче концентрации веществ. Количество прореагировавшего NH3 можно рассчитать по количеству любого из полученных веществ: например, соотношение NH3 и N2 по уравнению реакции составляет 2:1, значит, если после реакции образовалось 1,2 моль N2, то NH3 прореагировало в 2 раза больше: n(NH3) = 2 · 1,2 = 2,4 моль.
Начальная концентрация NH3 рассчитывается:
Снач = Спрореаг + Сравн = 2,4 + 0,4 = 2,8 моль/л.
Кр = 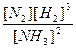 =
= 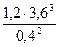 = 350
= 350
 2015-01-30
2015-01-30 32230
32230
