Вант-Гоффа записывается следующим образом:
Р = i CRT,
где i - изотонический коэффициент
Физический смысл изотонического коэффициента:
I= 
Изотонический коэффициент рассчитывают по формуле:
i =  (V–1)+1,
(V–1)+1, 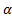 - степень диссоциации или ассоциации, выраженная в долях единицы,v- число ионов, образующихся при диссоциации одной молекулы или число, обратное количеству молекул в одном ассоциате (полимерной молекуле). Например, для NaClν = 2; для CaСl2ν = 3
- степень диссоциации или ассоциации, выраженная в долях единицы,v- число ионов, образующихся при диссоциации одной молекулы или число, обратное количеству молекул в одном ассоциате (полимерной молекуле). Например, для NaClν = 2; для CaСl2ν = 3
Роль осмотических явлений в различных физиологических процессах чрезвычайно велика. Постоянство осмотического давления тех или иных физиологических сред (плазма, внутриклеточная жидкость, моча и др.) представляет собой фундаментальное физико–химическое требование гомеостаза
1.Изотонический раствор - это раствор с осмотическим давлением, равным
давлению данной жидкости (стандарта). В медицине за стандарт обычно принимают плазму крови.(c клеткой ничего не происходит;это физ. р-р,вводят припотери крови)
2.Гипотонический - с меньшим давлением(клетка увеличивается(эндоосмос),не применяют в медицине(разрыв оболочки-цитолиз(разрыв эритроцитарной оболочки- гемолиз)),
3. гипертонический - с большим осмотическим давлением, чем стандарт. (клетка сжимается(плазмолиз),вводят большую дозу препарата в небольшом объёмеинъекции,глаукома(уменьшить избыточное кол-во влаги),при аллергиях.
В биологических жидкостях (моча, плазма, слюна, молоко и др.) в больших
количествах содержатся неорганические и органические вещества в виде
молекул, ионов и коллоидных частиц. Их суммарная концентрация носит
название осмотической концентрации (осмолярности)и именно эта величина
должна быть использована в уравнении Вант-Гоффа. Осмолярность:
СОСМ= iС,i-изотонический коэффициент.
8. Для живых организмов большое значение имеет растворимость О2,СО2,N2 в жидких средах организма. Растворимость газов зависит от давления и температуры. С повышением давления растворимость газов в жидкостях увеличивается, а с повышением температуры -падает. Для организма человека более важна зависимость растворимости газов от давления(т.к. изменения температуры незначительны и на растворимость существенно не влияют).
Зависимость растворимости газов от давления описывается закономГенри:
При постоянной температуре масса газа в определенном объёме жидкости прямо пропорциональна давлению газа:
С=к*Р; С-массовая концентрация газа в насыщенном р-ре, к-коэффициент, зависящий от природы газа, р-ля и от температуры, Р-давление газа над р-ром.
Если над жидкостью имеется смесь газов, то этот случай описывает законом Дальтона:
Растворимость каждого из компонентов газовой смеси при постоянной температуре прямо пропорциональна парциальному давлению компонента над жидкостью и не зависит от общего давления смеси:
С=к*Рi; Рi-парциальное давление. Рi=Pобщ*Х,где Х-молярная доля данного газа.
Х=  , где ni-число молей газа,
, где ni-число молей газа, 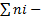 общее число молей газов, составляющих данную смесь.
общее число молей газов, составляющих данную смесь.
Исследованием растворимости газов в крови занимался русский физиолог И.М. Сеченов. Он установил, что растворимость газов в р-рах электролитов меньше, чем в чистом р-ле.
С=С0*е-ка, где С-растворимость газа в р-ре электролита,С0-растворимость газа в чистом р-ле,к-константа, зависящая от температуры и природы компонентов р-ра,а-концентрация электролита,е-основание натурального логарифма.
Значение закона Генри и Дальтона позволяет правильно анализировать газообмен в организме, происходящий, в основном, в легких. Поступление газов из воздуха в кровь и наоборот подчиняется закону Дальтона. Между парциальным давлениями газов в крови и воздухе существует различие, которое и обеспечивает обмен газов.
В соответствии с законом Сеченова не только низкомолекулярные электролиты,но и белки, липиды и другие в-ва,содержание которых в крови меняться в известных пределах, оказывают существенное влияние на растворимость кислорода и СО2 в крови.
 2018-01-21
2018-01-21 2391
2391
