впервые сформулирована И.Р. Пригожиным (бельгийский физик, 1946г.).
В открытой системе в стационарном состоянии прирост энтропии в
единицу времени 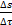 принимает минимальное положительное значение для данных условий,т.е
принимает минимальное положительное значение для данных условий,т.е
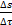 →min.
→min.
4. Закон Гесса (профессор Петербургского Университета, 1840 г).
Тепловые эффекты химических реакций, протекающих при
Постоянном объеме или постоянном давлении, зависит только от природы
И состояния исходных веществ и конечных продуктов и не зависит от
Пути, по которому реакция протекает.
В термохимических расчетах большое значение имеют следствия из закона
Гесса. Пользуясь ими, рассчитывают тепловые эффекты реакций при стандартных условиях.
I следствие.
Тепловой эффект реакции равен разности между суммой теплот
образования конечных веществ (т.е. продуктов реакции) и суммой теплот
образования исходных веществ с учетом стехиометрических коэффициентов.
 Н0Р-ЦИИ=∑(n∙
Н0Р-ЦИИ=∑(n∙  H0ОБР)КОН–∑(n∙
H0ОБР)КОН–∑(n∙  Н0ОБР)ИСХ
Н0ОБР)ИСХ
II следствие.
Тепловой эффект реакции равен разности между суммой теплот
сгорания исходных веществ и суммой теплот сгорания конечных веществ
(продуктов реакции) с учетом стехиометрических коэффициентов.
 Н0Р-ЦИИ= ∑(n∙
Н0Р-ЦИИ= ∑(n∙  H0СГОР)ИСХ–
H0СГОР)ИСХ–  (n∙
(n∙  H0СГОР)КОН
H0СГОР)КОН
III следствие.
Теплота образования органического соединения равна разности между
суммой теплот сгорания простых веществ, из которых оно может быть
получено, и теплотой сгорания самого соединения с учетом
стехиометрических коэффициентов реакции образования 1 моль сложного
вещества.
 Н0ОБР(ОРГ.С.)= ∑(n∙
Н0ОБР(ОРГ.С.)= ∑(n∙  H0СГОР)ПРОСТЫХ В-В –
H0СГОР)ПРОСТЫХ В-В –  Н0СГОР(ОРГ.С.)
Н0СГОР(ОРГ.С.)
Стандартная теплота (энтальпия) образования - это тепловой эффект
реакции образования 1 моль соединения из простых веществ при условии, что
все компоненты системы находятся в стандартных условиях. Обозначается
 Н0ОБР, выражается в кДж/моль. Энтальпии образования простых веществ,
Н0ОБР, выражается в кДж/моль. Энтальпии образования простых веществ,
если они устойчивы в стандартных условиях, условно принимают равными нулю.
Стандартная теплота (энтальпия) сгорания - это тепловой эффект
реакции сгорания 1 моль вещества при условии, что и исходные, и конечные
вещества находятся в стандартных условиях. Обозначается  Н0СГОР,
Н0СГОР,
выражается в кДж/моль. Конечными продуктами сгорания для органических
веществ принято считать СО2(Г), Н2О(Ж), SO2(Г), N2(Г)
Энергия, выделяемая при полном окислении (сгорании) 1 г питательных
веществ, называется их калорийностью.
Наибольшую энергетическую ценность имеют жиры, при окислении
которых выделяется 37,7 – 39,8 кДж/г (9,0 – 9,5 ккал/г). В процессе усвоения
углеводов в организме человека выделяется 16,5 – 17,2 кДж/г (4,0 – 4,1 ккал/г).
На этом же уровне находится калорийность и белков (4,0 – 4,1 ккал/г).
Биоэнергетику организма можно регулировать не только выбором продуктов,
но, главным образом, их сочетанием.
5. Катализом называется изменение скорости реакции в присутствии
веществ, которые, участвуя в процессе, к концу реакции остаются в неизменном виде и количестве.
Вещество, изменяющее скорость реакции, и в конце ее остающееся без изменения, называется катализатором.
Катализ бывает положительным, когда скорость реакции возрастает, и
отрицательным, когда скорость реакции уменьшается.
Различают катализ:
1. гомогенный, при котором катализатор и реагирующие вещества образуют гомогенную систему;
2. гетерогенный, при котором катализатор и реагирующие вещества находятся в разных фазах, чаще катализатор – твердый;
3. ферментативный – катализаторы – ферменты.
Особенности ферментов:
1. Высокая каталитическая активность, ускоряют в 106-108 раз.
2. Действие катализаторов специфично. Ускоряя скорость одной реакции,
они не влияют на скорость другой.
3.Ферменты действуют при невысоких температурах и давлениях, в водной среде.
4.Чувствительны к мельчайшим изменениям среды, рН и температуры.
1. Влияние температуры. Скорость ферментативных реакций
подчиняется правилу Вант–Гоффа(при повышении температуры на 10 градусов, скорость реакции возрастает в 2-4 раза), но имеются некоторые ограничения.
2. Влияние рН. Для каждого фермента (а значит и для скорости)
существует свой оптимум рН. Для каждого фермента существует определенное значение рН, при котором его действие оптимально. Для большинства ферментов оптимальные значения
рН совпадают с физиологическими значениями (7,3–7,4). Однако, существуют
ферменты, для нормального функционирования которых нужна сильнокислая
(пепсин – фермент желудочного сока – 1,0–2,0) или достаточно щелочная
(аргиназа – фермент, участвующий в удалении из организма NH3в виде
мочевины – 9,5–9,9) среда. Фермент слюны – амилаза, под действием которого
крахмал и гликоген распадаются до мальтозы, активен при рН, равном 6,8, что
соответствует рН слюны.
3. Влияние концентрации субстрата.
Объясняется теорией Михаэлиса–Ментен. Субстрат S (в-во) образует
с молекулой фермента Е (русское название фермента – энзим) соединение ES:
S+E=ES (1)
ES – фермент–субстратный комплекс, он может либо распадаться обратно до S
и E, либо образовывать продукт реакции Р и регенерированную молекулу
фермента Е:
E+S=E+P (2)
Скорость ферментативной реакции описывается уравнением Михаэлиса–
Ментен:
V= 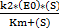 (3)
(3)
где k2– константа реакции распада фермент–субстратного комплекса, [Е0] – концентрация фермента (и связанного в комплекс, и свободного), [S] – концентрация субстрата, Km– константа Михаэлиса.
Биохимические реакции, как правило, протекают не с максимальной скоростью, это энергетически не выгодно, а со скоростью 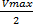 Эта скорость достигается при концентрации субстрата, равной Km. В этом – физический смысл константы Михаэлиса. То есть для обеспечения скорости, равной половине максимальной, требуется концентрация субстрата, равная константе Михаэлиса Km
Эта скорость достигается при концентрации субстрата, равной Km. В этом – физический смысл константы Михаэлиса. То есть для обеспечения скорости, равной половине максимальной, требуется концентрация субстрата, равная константе Михаэлиса Km
6.Химическое равновесие Понятие термодинамического равновесия нами уже рассматривалось (ΔG=0). Рассмотрим химическое равновесие с позиций химической кинетики. Пусть обратимая реакция описывается уравнением: aA+ bB= dD+fF. Во всех обратимых реакциях скорость прямой реакции уменьшается, а скорость обратной реакции возрастает до тех пор, пока скорости станут равными, и установится состояние равновесия. Это равновесие – динамическое
aA+ bB= dD+fF (1)
Запишем выражения для скорости прямой и обратной реакции:
V1=k1 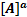 *
* 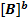 (2)
(2)
В состоянии равновесия V1=V2, т.е.
k1 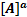 *
* 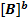 =k2
=k2 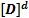 *
* 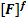 (3)
(3)
Поделим обе части уравнения на величину k2 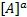 *
* 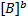 :
:
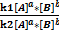 =
= 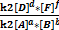 (4)
(4)
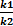 =КР-константа хим.равновесия (5)
=КР-константа хим.равновесия (5)
КР= 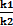 =
= 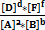
Константа химического равновесия КРравна отношению произведений концентраций продуктов к произведению концентраций реагентов с учетом стехиометрических коэффициентов. Это постоянная величина при постоянных внешних условиях. Чем выше константа равновесия, тем больше в равновесной реакционной смеси продуктов реакции. Чем ниже константа, тем больше исходных веществ. Например, для обратимой реакции связывания кислорода гемоглобином (HНв) с образованием оксигемоглобина (HНвО2) величина КР=1300 при 37оС. Это значит, что при давлении кислорода, равном 1атм., равновесная концентрация оксигемоглобина в 1300 раз превышает концентрациюгемоглобина. Другими словами, равновесие реакции сильно смещено вправо:
На химическое равновесие влияют следующие факторы: температура, концентрация, давление (газы), катализатор не влияет.
Принцип Ле Шателье: Если на систему, находящуюся в равновесии, воздействовать каким–либо фактором (Т, C, P, V), то равновесие сместится в направлении той реакции, протекание которой ослабляет этой воздействие.
1.Повышение температуры приводит к смещению химического равновесия в том направлении, при котором происходит поглощение теплоты (эндотермическая реакция), а понижение, наоборот, в сторону экзотермической реакции.
2. Повышение концентрации вещества смещает равновесие в сторону реакции, в результате которой его концентрация уменьшается.
3. Повышение давления (для газов) приводит к сдвигу химического равновесия в сторону образования веществ, занимающих меньший объем.
4. Катализатор не влияет на смещение химического равновесия, но может увеличить скорость достижения равновесия. Катализатор позволяет превратить самопроизвольную, но медленную реакцию в быстропротекающую; но никакой катализатор сам по себе не заставит осуществляться несамопроизвольную реакцию
 2018-01-21
2018-01-21 348
348








