N2+3H2=2NH3; 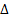 H<0;
H<0;
При увеличении C(N2) или C(H2) равновесие смещается вправо.
При увеличении С(NH3) влево
При повышении давления вправо, т.е. в сторону веществ, занимающих меньший объем, т.к. это понизит давление.
При повышении температуры влево, т.е. в сторону эндотермической реакции, при которой происходит поглощение теплоты
Катализатор не влияет на смещение химического равновесия.
Принцип Ле Шателье применим к живым организмам.
Любая равновесная живая система при воздействии на нее перестраивается так, чтобы уменьшить это воздействие. Например, в основе внешнего дыхания человека лежит равновесие между гемоглобином HНв и оксигемоглобином HНвO2:. Венозная кровь поступает в легкие, где оказывается при повышенном давлении кислорода. В соответствии с принципом Ле Шателье
равновесие смещается вправо, в сторону HНвO2, и кровь насыщается кислородом. Артериальная кровь, поступающая в ткани, оказывается при пониженном парциальном давлении кислорода. Равновесие сдвигается влево, в сторону образования HНв, и кровь отдает кислород тканям.
7. Осмос- это односторонняя диффузия молекул растворителя в сторону более концентрированного раствора через полупроницаемые мембраны.
Осмотическое давление – это избыточное гидростатическое давление,
возникающее в результате осмоса.
Вант-Гофф (нидерландский физико-химик, 1887 г.) установил закон,
согласно которому осмотическое давление раствора равно тому давлению,
Которое производило бы растворенное вещество, если бы оно при той же
Температуре находилось в газообразном состоянии и занимало объем,
 2018-01-21
2018-01-21 718
718








