Для неэлектролитов: Δtкип. = Е*Сm; Δtзам. =К*Сm
для электролитов и веществ, образующих ассоциаты:: Δtкип. = iЕ*Сm; Δtзам. =iК*Сm
где:  t КИП= t КИП. РАСТВОРА– t КИП. РАСТВОРИТЕЛЯ,
t КИП= t КИП. РАСТВОРА– t КИП. РАСТВОРИТЕЛЯ,
 t ЗАМ= t ЗАМ. РАСТВОРИТЕЛЯ– t ЗАМ. РАСТВОРА,
t ЗАМ= t ЗАМ. РАСТВОРИТЕЛЯ– t ЗАМ. РАСТВОРА,
Е - эбуллиоскопическая константа,
К - криоскопическая константа (Е и К приводятся в таблицах, зависят от
растворителя, но не зависят от растворенного вещества),
i- Изотонический коэффициент,
Cm- моляльная концентрация.
Моляльная концентрация рассчитывается по формуле:
Cm = 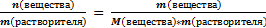
На измерении повышения температуры кипения и понижения температуры
замерзания растворов основаны методы исследования - эбуллиометрия (другое
название - эбуллиоскопия) и криометрия (криоскопия). Они применяются для
определения молярных масс, степени электролитической диссоциации или
ассоциации различных веществ
Для разбавленных растворов ВМС  t КИП.и
t КИП.и  t ЗАМ.слишком малы, поэтому
t ЗАМ.слишком малы, поэтому
определить молярные массы ВМС этими методами почти невозможно.
Молекулярные массы ВМС в разбавленных растворах определяют с помощью
метода осмометрии, измеряя их осмотическое давление, т.к. его можно
измерить значительно точнее, чем  t КИП.И
t КИП.И  t ЗАМ..
t ЗАМ..
Все коллигативные свойства растворов находятся во взаимосвязи. Зная
одно из них, можно рассчитать другое. Экспериментально определяемое
понижение точки кристаллизации плазмы крови человека обычно составляет 0,53гр.С, что соответствует моляльной концентрации 0,303 моль/кг и осмотическому давлению 7,8*10(2)кПа.
10.Буферные системы – это растворы, которые сохраняют постоянство рН при разбавлении водой или другим растворителем и при добавлении сильной кислоты или щелочи.
Буферные растворы - это растворы, содержащие несколько буферных систем (морская и речная вода, клеточный сок, кровь, слюна, моча и т.д.).
Буферные системы рассматривают на основе протолитической теории кислот и оснований. Теория называется протолитической или протонной потому, что главная роль в определении понятий кислота и основание отведена в ней протону H+.
В соответствии с этой теорией:
кислота- это вещество, частицы которого (молекулы или ионы) способны отдавать протоны (т.е. доноры протонов);
основание - это вещество, частицы которого (молекулы или ионы) способны присоединять протоны (акцепторы протонов).
Основание и кислота называются сопряженными, если они связаны соотношением:
ОСНОВАНИЕ+ ПРОТОН= КИСЛОТА
СН3СООН + Н2О= Н3О+ + СН3СОО-
к-та1 основ.2 к-та2 основ.1
 2018-01-21
2018-01-21 308
308








