Анилин — гораздо более слабое основание, чем алифатические амины. Это объясняется тем, что электронная пара атома азота, которая обусловливает основные свойства аминов, частично смещается в бензольное кольцо.
1.Анилин реагирует с сильными кислотами, образуя соли фениламмония C6H5NH3+, которые хорошо растворимы в воде, но нерастворимы в неполярных органических растворителях:
С6Н5NН2 + HCl → С6Н5NН3Сl.
2.Анилин весьма активен в реакциях электрофильного замещения в бензольном кольце. Это объясняется электронными эффектами, которые приводят к увеличению электронной плотности в кольце.
Анилин легко бромируется даже под действием бромной воды, давая белый осадок 2,4,6-триброманилина:

С концентрированной азотной кислотой анилин реагирует со взрывом, поэтому непосредственное нитрование осуществить не удается. Можно, однако, на время реакции защитить аминогруппу, если перед нитрованием превратить ее в амидную группу — NН-СО-СН3действием уксусного ангидрида, а после нитрования гидролизовать амид с образованием исходной аминогруппы. Данная последовательность реакций описывается схемой:
|
|
|
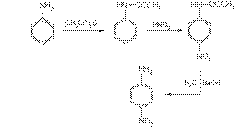
В этих реакциях образуется также небольшое количество орто-нитроанилина.
3. При реакции анилина с азотистой кислотой образуются диазосоединения — соли диазония C6H5N2+:
C6H5NH2 + NaNO2 + 2HCl → [C6H5-N≡N]+Cl— + NaCl + 2H2O.
Диазосоединения можно выделить в виде кристаллических, легко взрывающихся веществ. Благодаря способности диазониевой группы легко замещаться на другие функциональные группы, эти соединения широко используются в органических синтезах. Во многих случаях можно не выделять диазосоединения в кристаллическом виде, а использовать их свежеприготовленные растворы.
4. Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении. При действии хлорной извести Са(Сl)ОСl на водный раствор анилина появляется интенсивное фиолетовое окрашивание. Это — качественная реакция на анилин.
Применение. Основная область применения анилина — синтез красителей и лекарственных средств. В качестве примера приведем схему синтеза красителя метилового оранжевого (кислотно-основного индикатора):

25. Амиды кислот, их свойства. Мочевина (карбамид) как конечный продукт азотистого обмена. Химические свойства мочевины, ее важнейшие производные. Карбаминовая кислота, уретаны. (ответ в старых билетах номер 24)
Амиды- производные кислот, в которых гидроксильная группа замещена на аминогруппу.
 Мочевина, или карбамид, CO(NH2)2 представляет собой вещество, имеющее громадное значение при обмене веществ в животных организмах. Она содержится в больших количествах в моче человека и млекопитающих животных.
Мочевина, или карбамид, CO(NH2)2 представляет собой вещество, имеющее громадное значение при обмене веществ в животных организмах. Она содержится в больших количествах в моче человека и млекопитающих животных.
|
|
|
Для выделения мочевины мочу выпаривают с азотной кислотой, причем кристаллизуется азотнокислая соль мочевины, из которой обработкой карбонатом бария можно выделить свободную мочевину:
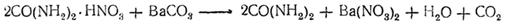
 Подобно другим амидам, мочевина при действии кислот и щелочей при нагревании может омыляться с образованием углекислоты и аммиака:
Подобно другим амидам, мочевина при действии кислот и щелочей при нагревании может омыляться с образованием углекислоты и аммиака:
Таже реакция может протекать под действием энзимов, называемых уреазами. Этим обусловлено так называемое «аммиачное брожение» мочи. Много уреазы содержит экстракт бобов сои.
 Действие на мочевину азотистой кислоты, как и в случае других амидов, ведет к образованию СО2 с выделением азота:
Действие на мочевину азотистой кислоты, как и в случае других амидов, ведет к образованию СО2 с выделением азота:
 Свободный азот выделяется из мочевины также при действии гипохлоритов и гипобромитов:
Свободный азот выделяется из мочевины также при действии гипохлоритов и гипобромитов:
Как показал П. И. Шестаков, первоначальным продуктом при действии брома и щелочи на мочевинуявляется гидразин NH2—NH2, образование которого аналогично образованию аминов из амидов кислот. Выделение азота есть результат дальнейшего действия гипохлоритов (или гипобромитов) на гидразин:

Производные изомочевины получаются присоединением спиртов к цианамиду в присутствии соляной кислоты:

КАРБАМИНОВАЯ КИСЛОТА NH2-COOH, в своб. виде не существует, известны производные карбаминовой кислоты: эфиры (уретаны), амид (мочевина), нитрил (цианамид), гидразид (семикарбазид), соли (карбаматы), галогенангидриды (карбамоилгалогениды) и т.п.. Соли карбаминовой кислоты (карбаматы) малостабильны. При действии воды гидролизуются, образуя NH3 и соответствующие карбонаты. При нагр. в отсутствие воды карбаматы щелочных металлов превращаются в цианаты, а карбаматы щел.-зем. металлов - в цианамиды. наиб. доступный карбамат - аммониевая соль карбаминовой кислоты NH2COONH4, т. возг. 60 °С (с разл.); гигроскопич. кристаллы, хорошо раств. в воде, водном NH3, плохо - в этаноле; получают взаимод. СО2 и NH3; промежут. продукт (без выделения) в произ-ве мочевины, в к-рую превращ. при нагр. под давлением; содержится в товарном карбонате аммония; применяется для получения др. карбаматов. Хлорангидрид карбаминовой кислоты (карбамоилхлорид) NH2COCl бесцв. резкопахнущая жидкость, т. кип. 61-62°С (с разл.); разлагается на циануровую к-ту и НСl уже при стоянии, легче - при нагр. получают действием фосгена на NH4Cl или аммиак при повыш. т-ре, напр.: NH4 Cl + СОСl2: NH2COCl + 2НСl
26. Аминокислоты. Классификация, номенклатура, изомерия аминокислот. Природные α-аминокислоты L- ряда. Незаменимые аминокислоты. Изоэлектрическая точка.(ответ в старых билетах номер 25)
Амфотерность является основным физико-химическим свойством аминокислот.
Понятие амфотерность означает, что вещество сочетает в себе свойства как кислот, так и оснований. В водном растворе аминокислоты одновременно ведут себя как кислоты – доноры протонов и как основания – акцепторы протонов. Данное свойство аминокислот напрямую связано со амфотерными свойствами белков, благодаря которому они участвуют в регуляции кислотно-основного состояния крови.
Если общий заряд аминокислоты равен 0, то это ее состояние называют изоэлектрическим.
Величина рН, при которой заряд аминокислоты равен 0, называется изоэлектрической точкой (ИЭТ, pI). Значение изоэлектрической точки зависит от строения радикала аминокислоты:
ИЭТ большинства аминокислот располагается в диапазоне рН от 5,5 (фенилаланин) до 6,3 (пролин),
ИЭТ кислых аминокислот - для глутамата 3,2, для аспартата 2,8,
ИЭТ основных аминокислот - для гистидина 7,6, для аргинина 10,8, для лизина 9,7.
Заряд аминокислот зависит от величины рН среды и от строения их радикала.
При снижении концентрации ионов водорода в растворе (защелачивание среды) повышается их отрыв от аминогруппы и карбоксигруппы аминокислот. Иными словами, от аминокислоты уходит положительный заряд и она становится отрицательно заряженной. Когда рН снижается (закисление среды), то имеющиеся в растворе ионы Н+ присоединяются к амино- и карбоксигруппам – заряд аминокислоты становится положительным.
|
|
|

27. Химические свойства аминокислот: амфотерность, образование солей, специфические реакции α -,β -, γ-аминокислот. Метаболические превращения аминокислот. Реакции дезаминирования, гидроксилирования. Декарбоксилирование α -аминокислот - путь к образованию биогенных аминов и биорегуляторов (коламин, гистамин, триптамин, серотонин, кадаверин, катехоламины). Образование ди-, три- и полипептидов из α -аминокислот. Пептиды. Пептидная связь. (ответ в старых билетах номер 26)
Реакция гидроксилирования аминокислот:

В результате гидроксилирования в боковой радикал вводится гидроксильная группа.
Декарбоксилирование a-аминокислот – путь к образованию биогенных аминов и биорегуляторов (коламин, гистамин, триптамин, серотонин, кадаревин, катехоламины).
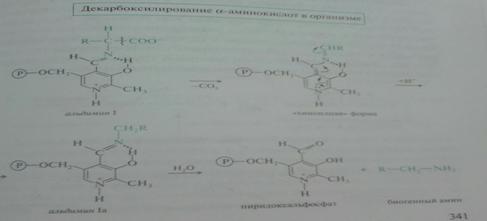
Гистамин образуется при декарбоксилировании гистидина, оказывает широкий спектр биологического действия: вызывает расширение капилляров (обладает сосудорасширяющим действием в отличие от других биогенных аминов), повышение их проницаемости (жидкость из крови выходит в межклеточную среду, что приводит к уменьшению объема крови), понижает АД, стимулирует секруцию желудочного сока и слюны, усиливает секрецию соляной кислоты в желудке; сокращает гладкие мышцы легких, что может вызвать «гистаминовый шок», что проявляется как приступ удушья; участвует в развитии болевых ощущений.

Серотонин образуется из триптофана в нейронах гипоталамуса, функционирует как нейромедиатор в ЦНС, оказывает мощное сосудосуживающее действие, регулирует АД, температуру тела, дыхание, почечную фильтрацию.

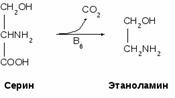
Коламин (Этаноламин) образуется при декарбоксилировании серина. Используется для синтеза холина, ацетилхолина, фосфолипидов (фосфатидилэтаноламина, фосфатидилхолина).
Триптамин образуется при декарбоксилировании триптофана.
|
|
|

Кадаверин образуется при декарбоксилировании лизина.

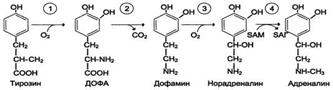
Катехоламины (дофамин, адреналин, норадреналин) синтезируются из аминокислоты тирозина.
 2018-01-21
2018-01-21 2770
2770
