29. Биологически активные гетероциклы. Пяти- и шестичленные гетероциклические Соединения с одним гетероатомом: фуран, тиофен, пиррол, пиридин, индол, хинолин. Их свойства и важнейшие производные. Пиррольный и пиридиновый атомы азота. Гидрирование пиррола. Порфириновый цикл и его производные. Производные пиридина и фурана как фармпрепараты. Никотинамид, тубазид и др. (ответ в старых билетах номер 28)
 Соединения с
Соединения с
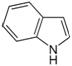
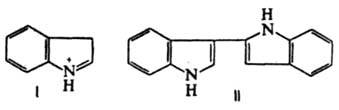
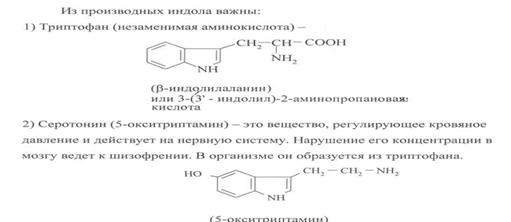
Индол - слабое основание.При протонировании образует катион 3H-индолия (ф-ла I), к-рый при взаимод. с нейтральной молекулой индол дает димер (II).
Как слабая к-та (рKа 17), индол с Na в жидком NH3 образует N-натрийиндол, с КОН при 130°С - N-калийиндол. Обладает ароматич. св-вами. Электроф. замещение идет гл. обр. в положение 3. Нитрованиеобычно осуществляется бензоилнитратом, сульфирование - пиридинсульфотриоксидом, бромирование - диоксандибромидом, хлорирование - SO2Cl2, алкилирование - активными алкилгалогенидами.Ацетилирование в уксусной к-те также идет в положение 3, в присут. CH3COONa - в положение 1; в уксусном ангидриде образуется 1,3-диацетилиндол. Индол легко присоединяется по двойной связи -непредельных кетонов и нитрилов, напр.:
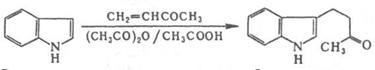
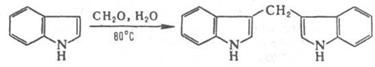
Взаимод. с альдегидами приводит к образованию дииндолильных производных, напр.:
Аминометилирование (р-ция Манниха) в мягких условиях протекает в положение 1, в жестких - в положение 3. Замещение в бензольное кольцо (преим. в положения 4 и 6) идет лишь в кислых средах при блокированном положении 3. В присут. Н2О2, надкислот или на свету индол окисляется в индоксил, к-рый затем превращ. в тример или индиго. Более жесткое окисление под действием О3, МnО2 приводит к разрыву пиррольного кольца с образованием 2-формамидобензальдегида. При гидрировании индола водородом в мягких условиях восстанавливается пиррольное кольцо, в более жестких - и бензольное, напр.:
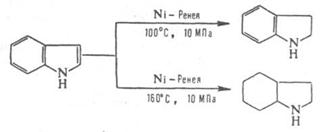
Индол содержится в эфирных маслах жасмина и цитрусовых, входит в состав кам.-уг. смолы. Кольцо индола - фрагмент молекул важных прир. соединений (напр., триптофана, серотонина, мелатонина, буфотенина). Обычно индол выделяют из нафталиновой фракции кам.-уг. смолы или получают дегидрированием о-этиланилина с послед. циклизацией образующегося продукта. Индол и его производные синтезируют также циклизацией арилгидразонов карбонильных соед. (р-ция Фишера), взаимод. ариламинов с -галоген- или -гидроксикарбонильными соед. (р-ция Бишлера) и др. Ядро индола входит в состав индольных алкалоидов. Сам индол-фиксатор запаха в парфюмерии; его производные используют в произ-ве биологически активных соед. (гормонов, галюциногенов) и лек. ср-в (напр., индопана, индометацина).
|
|
|
|
|
|
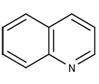 Хинолин
Хинолин
По химическим свойствам хинолин схож с пиридином. Для него характерны реакции:
• с участием гетероатома;
• электрофильного и нуклеофильного замещения;
• окисления;
• восстановления.
Хинолин обладает бактерицидным, антисептическим и жаропонижающим действием, но в медицине не применяется из-за высокой токсичности (низкого значения терапевтического индекса). В настоящее время синтезированы многочисленные производные хинолина с различной фармакологической активностью и среди них хинин, являющийся противомалярийным средством
Производные хинолина: хинин, плазмоцид.
Производные пиридина
Пиридин не применяется в медицине в силу своей высокой токсичности, хотя и обладает сильным бактерицидным действием. Однако введением в его молекулу различных функциональных групп можно снизить его токсичсность. Это послужило основой для синтеза его многочисленных производных, являющихся ценными лекарственными средствами различного терапевтического действия. Никотиновая кислота и никотинамид — важные лекарственные препараты.
Производные фурана.
• Амиодарон;
• Гризеофульвин.
• ЛС нитрофуранового ряда:
нитрофурал (фурацилин), фуразолидон, нитрофурантоин (фурадонин), фурагин.
• Амиодарон – анитиаритмическое ЛС – блокатор калиевых и кальциевых (в меньшей степени) каналов мембран кардиомиоцитов; обладает свойством вазодилататора (снижает сопротивление коронарных сосудов)
• Гризеофульвин – антибиотическое ЛС- нарушает формирование и деление грибковой клетки.
• Нитрофурал (фурацилин), фуразолидон, нитрофурантоин (фурадонин), фурагин – антибактериальные ЛС, молекулярные механизмы действия – нарушение синтеза ДНК и белка микробных клеток;
Никотинамид – витамин РР. Активное воздействие витамина PP на обменные процессы обусловлено его вхождением в состав ниацинамидадениндинуклеотида (НАД) и ниацинамидадениндинуклеотида фосфата (НАДФ), являющихся кофакторами ряда ферментов. В частности, ниацинамид входит в состав кодегидраз, являющихся переносчиками водорода к флавопротеиновым ферментам, и тем самым регулирует окислительно-восстановительные процессы в организме.
Тубазид
Противотуберкулезное средство I ряда. Оказывает бактерицидное действие. Изониазид активен в отношении вне- и внутриклеточных Mycobacterium tuberculosis, прежде всего в отношении активно делящихся. Точный механизм его действия неизвестен. Предполагается, что он связан с подавлением синтеза миколиевых кислот, входящих в состав клеточной стенки микобактерий.
30. Пятичленные гетероциклы с двумя гетероатомами: пиразол, тиазол. имидазол. Пиразолоновое кольцо в фармпрепаратах (антипирин, амидопирин). Тиазол, тиазолидин, медико-биологическое значение. Имидазол (прототропная таутомерия), гистидин. Шестичленные гетероциклы с двумя гетероатомами: пиридазин, пиразин, пиримидин. Ароматический характер, основные свойства. Оксипроизводные пиримидина. Барбитуровая кислота и барбитураты. Лактим-лактамная таутомерия. Пиримидиновые основания: урацил, тимин, цитозин. (ответ в старых билетах номер 29)
 2018-01-21
2018-01-21 846
846








