Водородная связь обеспечивает низкомолекулярным веществам способность быть при обычных условиях в жидком агрегатном состоянии (этанол, метанол, вода) или сжижающимися газами (аммиак, фтороводород).
Более высокая температура кипения воды (100 оС) по сравнению с водородными соединениями элементов подгруппы кислорода (Н2S, Н2Sе, Н2Те), так как затрачивается дополнительная энергия на разрушение водородных связей.
Также при плавлении воды её плотность возрастает. Это объясняется тем, что в структуре льда каждый атом кислорода связан через атомы водорода с четырьмя другими атомами кислорода других молекул воды. В результате образуется рыхлая «ажурная» структура.
Вопрос
В различных реакциях, протекающих в растворе, мы обнаруживаем участие неизменных группировок атомов, выступающих либо в виде ионов (SO42 , OH, NO2, CO32, NO2+ и т.д.), либо в виде нейтральных молекул (NH3, CO, NO и других). Эти неизменные группировки атомов способны к взаимодействию в растворе с ионами металлов или нейтральными молекулами с образованием более сложных частиц. Например, ион Cu2+взаимодействует в растворе с молекулами NH3 по обратимой реакции с образованием сложного катиона:
Cu2+ + 4 NH3  [Cu(NH3)4]2+
[Cu(NH3)4]2+
а ион Fe2+ легко присоединяет ионы CN, образуя сложный анион:
Fe2+ + 6 CN 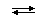 [Fe(CN)6]4
[Fe(CN)6]4
Молекула SnCl4 может присоединить два иона Cl и образовать сложный анион:
SnCl4 + 2 Cl 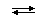 [SnCl6]2
[SnCl6]2
Две молекулы BF3 и NH3 могут взаимодействовать с образованием более сложной частицы:
BF3 + NH3 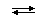 [B(NH3)F3]0
[B(NH3)F3]0
Можно привести множество других примеров подобного рода. Во всех случаях знак обратимости подчеркивает, что образование сложных частиц (ионов и молекул) не протекает до конца, в растворе всегда можно найти не только продукты реакции, но и исходные ионы и молекулы.
Образовавшиеся новые соединения приобретают новые свойства, отличные от свойств составляющих их простых соединений – например, совершенно иную окраску, растворимость и способность взаимодействовать с различными реагентами. Так, иодид ртути(II) взаимодействует в растворе с нитратом серебра с образованием малорастворимого иодида серебра:
HgI2 + 2 AgNO3 = 2 AgI + Hg(NO3)2
После образования сложного соединения с иодидом калия по реакции
HgI2 + 2 KI = K2[HgI4]
свойства иодида ртути(II) как индивидуального вещества исчезают. Продукт состава K2[HgI4] обладает другими химическими свойствами, поскольку образовавшийся сложный анион [HgI4]2 ведет себя в обменных реакциях как неразрывное целое:
K2[HgI4] + 2 AgNO3 = Ag2[HgI4] + 2 KNO3
Подобные сложные образования получили название комплексных ионов или молекул.
Таким образом, комплексным соединением называют сложное соединение, образующееся при взаимодействии более простых неизменных частиц (атомов, ионов или молекул), каждая из которых способна существовать независимо в обычных условиях.
Реакции, в результате которых образуются комплексные соединения, носят название реакций комплексообразования. Пример реакции комплексообразования – взаимодействие SnCl4 и Cl с получением сложного комплексного аниона [SnCl6]2:
SnCl4 + 2 Cl 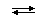 [SnCl6]2
[SnCl6]2
В то же время, например, перхлорат-анион ClO4 не является комплексным, поскольку простые неизменные группировки атомов, на которые он мог бы диссоциировать в обычных условиях, неизвестны.
Комплексные ионы образуют с ионами противоположного заряда комплексные соединения. Так, комплексный ион [Fe(CN)6]3 образует с ионами K+ комплексное соединение K3[Fe(CN)6], которое выделяется из водного раствора при его выпаривании в виде кристаллов красного цвета, хорошо растворимых в воде.
Комплексный катион [Cu(NH3)4]2+ образует с анионами SO42 комплексное соединение [Cu(NH3)4]SO4 . 2 H2O, выделяющееся из раствора в виде темно-синих кристаллов, легко разлагающихся на воздухе и при небольшом нагревании.
В дальнейшем комплексными соединениями, или просто комплексами, мы будем называть и комплексные ионы, и комплексные молекулы.
Комплексные соединения называют часто координационными соединениями, подчеркивая тем самым способность простых неизменных частиц определенным образом располагаться (координироваться) друг около друга в комплексном ионе или комплексной молекуле.
Химия комплексных соединений является частью неорганической химии. Она охватывает как чисто неорганические комплексы, так и комплексные соединения, включающие частицы органической природы.
Природу химических связей в комплексах, их строение и принципы их образования объясняет координационная теория.
Вопрос
 2018-01-21
2018-01-21 1801
1801








