Вся область химии пронизана явлениями, имеющими электрохимическую природу. Сюда относятся процессы образования внутримолекулярных связей, окислительно-восстановительные реакции, явления гидратации и ионизации в растворах и многое другое. Однако к области собственно электрохимии относят только те химические реакции, которые непосредственно связаны с перемещением электрических зарядов, т.е. с электрическим током – реакции, которые вызывают электрический ток или обуславливаются им.
Можно выделить следующие особенности электрохимических реакций:
1) они относятся к числу окислительно-восстановительных процессов;
2) протекают только в пограничной области (электрод – электролит), т.е. имеют вид приэлектродных химических процессов, при этом на одном из электродов идет реакция окисления, а на другом – восстановления;
3) при протекании электродных реакций наблюдаются взаимопревращения электрической и химической энергий.
Электрохимия – это раздел химии, посвященный изучению явлений возникновения электрического тока в результате окислительно- восстановительных реакций, протекающих на электродах, а также изучению химических процессов, обусловленных действием электрического тока на вещества. В соответствии с этим, электрохимию можно разделить на два основных раздела:
1. Учение о химических источниках химическое энергии (гальванические элементы и аккумуляторы).
2. Учение о химическом действии электрического тока (электролиз и гальванотехника).
Электродный потенциал
Если в чистую воду опустить металлическую пластину, то поверхностно расположенные ионы металла будут гидратироваться полярными молекулами воды. В результате этого, связь поверхностно распложенных катионов с металлической пластиной ослабляется, металл будет как бы поверхностно растворятся. (См. рисунок.)
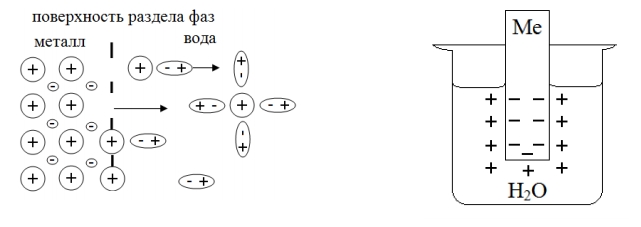
Гидратированные катионы начнут вовлекаться в общее тепловое движение в жидкости, а электроны, остающиеся в избытке в металле, заряжают его поверхностный слой отрицательно. Возникает электростатическое притяжение между перешедшими в раствор катионами и поверхностью металлическое пластинки. Это препятствует дальнейшему растворению металла.
В системе устанавливается подвижное равновесие, которое характеризуется равными скоростями растворения металла, и обратного осаждения его из раствора на поверхность металлической пластины. В результате взаимодействия двух указанных взаимно противоположных сил, растворение металла в воде приобретает характер только поверхностного процесса и охватывает очень узкую область на границе металл – жидкость.
При этом если считать на объем всей системы, растворимость металла чрезвычайно мала. В то же время, концентрация поверхностного раствора может быть значительной.
Таким образом, в пограничном слое жидкости за счет гидратированных катионов металла, создается избыточный положительный заряд. Следовательно, на границе металл – жидкость возникает двойной электрический слой.
Создается пограничная разность потенциалов, называемая электродным потенциалом. Если жидкая среда – чистая вода, то качественно для всех металлов картина однозначная: металл заряжается отрицательно, а прилежащий к нему слой жидкости – положительно. Однако количественно для разных металлов будут наблюдаться существенные различия. То есть величина электродного потенциала для разных металлов различна, она зависит от энергии связи катионов металла в кристаллической решетке и от величины их эффективного радиуса.
 2018-01-21
2018-01-21 1337
1337








