Гидролизом называется взаимодействие вещества с водой, при котором составные части вещества соединяются с составными частями воды.
Гидролизу подвержены соединения различных классов: соли, галогениды, карбиды, белки, жиры, углеводы и т.д.
В реакции гидролиза вступают соли, образованные слабой кислотой и сильным основанием, или сильной кислотой и слабым основанием, слабой кислотой и слабым основанием.
Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются; нейтрализация в этом случае сводится к процессу Н + +ОН- =Н2О, а обратная реакция – диссоциация молекулы воды на ионы – протекает в ничтожно малой степени.
Рассмотрим гидролиз соли, образованной одноосновной кислотой и одновалентным металлом. В качестве примера возьмем ацетат натрия – соль слабой кислоты и сильного основания. CH3COONa+H2O↔CH3COOH+NaOH, или в ионно-молекулярной форме: CH3COO- +H2O↔CH3COOH+OH- рН>7.
Уравнение показывает, что в данном случае гидролизу подвергается анион соли, и что реакция сопровождается образованием гидроксид-ионов. Но поскольку ионное произведение воды есть величина постоянная, то при накоплении OH- -ионов концентрация ионов водорода уменьшается. Следовательно, растворы солей, образованные слабой кислотой и сильным основанием имеют щелочную реакцию.
В случае соли, образованной слабым основанием и сильной кислотой, гидролизу подвергается катион соли и реакция сопровождается образование ионов водорода: NH4Cl+H2O↔NH4OH+HCl, или NH4 + +H2O↔NH4OH+H
Накопление ионов водорода приводит к уменьшению концентрации гидроксид-ионов.
Таким образом, растворы солей, образованные слабым основанием и сильной кислотой имеют кислую реакцию.
В рассмотренных случаях гидролизу подвергается не все количество находящейся в растворе соли, а только его часть. Иначе говоря, в растворе устанавливается равновесие между солью и образующими ее кислотой и основанием. Доля вещества, подвергающаяся гидролизу, называется степенью гидролиза (h), она зависит от константы равновесия, а также от температуры и концентрации соли.

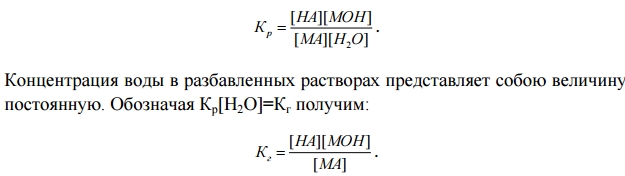
Величина Кг называется константой гидролиза соли.
Ее значение характеризует способность данной соли подвергаться гидролизу.
Чем больше Кг, тем в большей степени (при одинаковых температуре и концентрации) протекает гидролиз. Для случая соли, образованной слабой кислотой и сильным основанием, константа гидролиза связана с константой диссоциации слабой кислоты:. 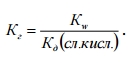
Это уравнение показывает: чем слабее кислота, тем в большей степени подвергаются гидролизу ее соли. Для солей, образованных слабым основанием и сильной кислотой, аналогичное соотношение связывает константу гидролиза с константой диссоциации слабого основания: 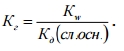 .
.
Поэтому, чем слабее основание, тем в большей степени подвергаются гидролизу образованные им соли.
Для солей, образованных слабой кислотой и слабым основанием, константа гидролиза связана с константами диссоциации соответствующих кислоты и основания:
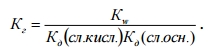
Степень гидролиза определяется природой соли, ее концентрацией и температурой. Природа соли проявляется в величине константы гидролиза. Зависимость от концентрации выражается в том, что с разбавлением раствора степень гидролиза увеличивается. Влияние температуры вытекает из принципа Ле Шателье. Все реакции нейтрализации протекают с выделением теплоты, а гидролиз с поглощением теплоты. Поскольку выход эндотермической реакции с ростом температуры увеличивается, то и степень гидролиза растет с повышением температуры.
26. Гидролиз солей. Ступенчатый гидролиз. Соли, подвергающиеся ступенчатому гидролизу. 
 2018-01-21
2018-01-21 1954
1954
