Это реакции, в ходе которых происходит изменение степени окисления одного или нескольких элементов, входящих в состав реагирующих веществ. В качестве примера может служить реакция взаимодействии металла с кислотой: Zn+2HCl=ZnCl2+H2. В данном случае происходит изменение степени окисления цинка от 0 до +2, а водорода от +1 до 0. ОВР имеют очень большое значение в биологических системах.
Фотосинтез, дыхание, пищеварение – это все цепи окислительно-восстановительных реакций. В технике ОВР также важны, вся металлургическая промышленность основана на окислительно-восстановительных процессах, в ходе которых металлы выделяются из природных соединений.
Когда элемент находится в свободном состоянии – образует простое вещество, – тогда движение электронов около всех атомов этого вещества происходит одинаково. Это справедливо для всех простых веществ независимо от их структуры.
Например, в молекуле водорода электроны в равной мере движутся около обоих атомов: молекула водорода неполярна.
В случае кристаллов с ковалентной связью, химические связи между атомами симметричны относительно связуемых атомов.
В случае металлов, распределение как связанных, так и свободных электронов, в среднем, также является равномерным.
Иначе обстоит дело в сложных веществах. Химические связи между атомами различных элементов несимметричны. В молекулах сложных веществ осуществляются, как правило, полярные ковалентные связи. В ионных соединениях эта неравномерность распределения электронов максимальна – при образовании веществ с ионной связью валентные электроны практически полностью переходят от атома одного элемента к атому другого.
При смещении электронов в молекуле от одного атома к другому элементы переходят в окисленное состояние.
При этом элемент, электроны которого смещаются к атомам другого элемента, проявляет положительную окисленность. А элемент, к атомам которого смещаются электроны от атомов другого элемента проявляет отрицательную окисленность.
Число электронов, смещенных в молекуле от одного атома или к одному атому, называется степенью окисления элемента.
В простых веществах степень окисления элемента всегда равна нулю (Mg, Al, H2, Cl2…). В соединениях некоторые элементы проявляют всегда одну и ту же степень окисления, но для большинства элементов она в различных соединениях различна.
Постоянную степень окисления имеют щелочные металлы (+1), щелочноземельные металлы (+2), фтор (-1).
Для водорода в большинстве соединений характерна степень окисления +1, а у кислорода она как правило -2.
Для элементов с непостоянной степенью окисления, ее значение всегда нетрудно рассчитать, зная формулу соединения и учитывая, что сумма степеней окисления всех атомов в молекуле равна нулю.
Окисление, восстановление, окислитель, восстановитель. Важнейшие окислители и восстановители. Примеры
Окислительно-восстановительные реакции. Это реакции, в ходе которых происходит изменение степени окисления одного или нескольких элементов, входящих в состав реагирующих веществ. В качестве примера может служить реакция взаимодействии металла с кислотой: Zn+2HCl=ZnCl2+H2.
В данном случае происходит изменение степени окисления цинка от 0 до +2, а водорода от +1 до 0.
ОВР имеют очень большое значение в биологических системах. Фотосинтез, дыхание, пищеварение – это все цепи окислительно- восстановительных реакций. В технике ОВР также важны, вся металлургичеcкая промышленность основана на окислительно-восстановительных процессах, в ходе которых металлы выделяются из природных соединений.
Рассмотрим реакцию образования сложного соединения из простых: 2Na+Cl2=2NaCl.
Эта реакция, как всякая гетерогенная реакция, протекает в несколько стадий. В ходе одной из них атомы натрия превращаются в положительно- заряженные ионы, степень окисления натрия изменяется от 0 до +1:
. Такой процесс – отдача электронов, сопровождающийся повышением степени окисления элемента, – называется окислением.
Электроны, отдаваемые натрием, принимаются атомами хлора, которые превращаются при этом в отрицательно-заряженные ионы, степень окисления хлора изменяется
от 0 до -1: Cl2+2e- =2Cl-. Присоединение электронов, сопровождающееся понижением степени окисления элемента, называется восстановлением.
Таким образом, в рассматриваемой реакции натрий окисляется, а хлор восстанавливается. Вещество, в состав которого входит окисляющийся элемент, называется восстановителем, а вещество, содержащее восстанавливающийся элемент, – окислителем. Следовательно, в данном примере натрий – восстановитель, а хлор – окислитель. Из уравнений процессов восстановления и окисления видно, что одна молекула хлора, восстанавливаясь, присоединяет два электрона, а окисление одного атома натрия сопровождается отдачей одного электрона.
Общее число электронов в системе при химических реакциях не изменяется: число электронов, отдаваемых восстановителем, равно числу электронов принимаемых окислителем. Поэтому одна молекула хлора может окислить два иона натрия.
29.Составление уравнений окислительно-восстановительных реакций методом электронного баланса. На примере реакции: HJ+H2SO4=J2+H2S+H2O
Рассмотрим реакцию взаимодействия между иодоводородом и концентрированной серной кислотой: HJ+H2SO4=J2+H2S+H2O.
Определяем степень окисления каждого из элементов в данной системе.
Выяснилось, что в процессе реакции йод изменяет свою с.о. от -1 до 0, и сера от +6 до -2. Оставляем соответствующие уравнения процессов окисления и восстановления: 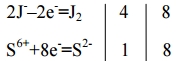
Как говорилось ранее, количество электронов, принятых и отданных в процессе окислительно-восстановительной реакции должно быть одинаковым, следовательно реакцию процесса окисления умножаем на четыре. Теперь расставляем коэффициенты пред молекулами, в которых содержатся атомы, изменившие в процессе реакции степень окисления, согласно записи электронного баланса: 8HJ+H2SO4=4J2+H2S+4H2O.

 2018-01-21
2018-01-21 2206
2206
