Вода́ (Н2O) — молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью. Прозрачная жидкость, не имеет цвета, запаха и вкуса. В твёрдом состоянии называется льдом, а в газообразном — водяным паром.
Вода при нормальных условиях находится в жидком состоянии. Молекула воды обладает большим дипольным моментом. Каждая молекула воды образует до четырёх водородных связей — две из них образует атом кислорода и две — атомы водорода. Количество водородных связей и их разветвлённая структура определяют высокую температуру кипения воды и её удельную теплоту парообразования.
При переходе в твёрдое состояние молекулы воды упорядочиваются, при этом объёмы пустот между молекулами увеличиваются, и общая плотность воды падает, что и объясняет меньшую плотность (больший объём) воды в фазе льда. При испарении, напротив, все водородные связи рвутся.
Вода обладает также высоким поверхностным натяжением, уступая в этом только ртути. Относительно высокая вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
Вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Вода является наиболее распространённым растворителем на планете Земля. Вода — химически активное вещество. Сильно полярные молекулы воды сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты. Сольволиз, и в частности гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности.
Вода реагирует при комнатной температуре: с активными металлами, со фтором и межгалоидными соединениями, с солями, образованными слабой кислотой и слабым основанием, с железом, магнием, с углем, метаном.
Вода реагирует в присутствии катализатора: с амидами, эфирами карбоновых кислот; с ацетиленом и другими алкинами; с алкенами; с нитрилами.
Перокси́д водоро́да (H2O2) — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем.
Молекула пероксида водорода имеет следующее строение:

Получение. Пероксид водорода может быть получен каталитическим окислением изопропилового спирта:
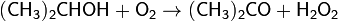 ,
,
при этом ценным побочным продуктом этой реакции является ацетон.
В лабораторных условиях для получения пероксида водорода используют реакцию:

Концентрирование и очистку пероксида водорода проводят осторожной перегонкой.
Сера, методы получения, полиморфные модификации, физические и химические свойства. Сероводород, строение молекулы, получение и свойства. Сульфиды. Гидролиз сульфидов, растворимых в воде.
Се́ра — элемент 16-й группы, третьего периода периодической системы химических элементов, с атомным номером 16. Проявляет неметаллические свойства.
Три полиморфные модификации, из которых в природных условиях устойчивой является лишь ромбическая модификация – α-сера. При атмосферном давлении и температуре выше 96,5° она переходит в β-серу моноклинной сингонии, а при охлаждении вновь возвращается в прежнее кристаллическое состояние, γ-сера – также моноклинная, но неустойчива при атмосферном давлении при всех температурах; при комнатной температуре превращается в α-серу.
Известно несколько методов получения серы из серных руд: пароводяные, фильтрационные, термические, центрифугальные и экстракционные.
Полученная химически чистая мелкодисперсная сера является идеальным сырьём для химической и резиновой промышленности.
Физические свойства: сера существенно отличается от кислорода способностью образовывать устойчивые цепочки и циклы из атомов. Наиболее стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета. В воде сера нерастворима, но хорошо растворяется в органических растворителях, например, в сероуглероде, скипидаре.
На воздухе сера горит, образуя сернистый газ — бесцветный газ с резким запахом:

Восстановительные свойства серы проявляются в реакциях серы и с другими неметаллами, однако при комнатной температуре сера реагирует только софтором. При температуре сера реагирует с хлором, фосфором, водородом, углеродом, кремнием, со многими металлами.
Сероводоро́д H2S — бесцветный газ со сладковатым вкусом, имеющий запах протухших куриных яиц. Бинарное химическое соединение водорода и серы. Плохо растворим в воде, хорошо — в этаноле. В больших концентрациях ядовит, взаимодействует со многими металлами. Огнеопасен. Термически неустойчив (при температурах больше 400 °C разлагается на простые вещества — S и H2).
Молекула сероводорода имеет изогнутую форму, поэтому она полярна. Сероводород является газом. Раствор сероводорода в воде — очень слабая сероводородная кислота. Является сверхпроводником.
Химические свойства: В воде сероводород мало растворим, водный раствор H2S является очень слабой кислотой, реагирует со щелочами. Сероводород — сильный восстановитель. В воздухе горит синим пламенем.
Получение: Взаимодействием разбавленных кислот с сульфидами:

· Взаимодействие сульфида алюминия с водой, сплавлением парафина с серой.
Соли сероводородной кислоты называют сульфидами. В воде хорошо растворимы только сульфиды щелочных металлов, аммония. Сульфиды остальных металлов практически не растворимы в воде, они выпадают в осадок. Многие сульфиды ярко окрашены.
Для всех щелочных и щелочноземельных металлов известны также гидросульфиды M+HS и M2+(HS)². Гидросульфиды Са²+ и Sr2+ очень нестойки. Являясь солями слабой кислоты, в водном растворе растворимые сульфиды подвергаются гидролизу. Гидролиз сульфидов, содержащих металлы в высоких степенях окисления, либо гидроксиды которых являются очень слабыми основаниями, часто проходит необратимо с выпадением в осадок нерастворимого гидроксида.
41. Соединения серы с кислородом. Диоксид и триоксид серы – получение, свойства, применение .
Все кислородные соединения серы являются экзотермическими.
Оксиды: известны как высшие, так и низшие оксиды серы. К последним относятся такие неустойчивые оксиды, как S2O3 и S2O. Например, S2O образуется в зоне электрического разряда, проходящего в атмосфере SO2, и тут же разлагается:
2 S2O = 3S + SO2,
аналогично диспропорционирует и S2O3
2 S2O3 = S + 3 SO2.
Из высших оксидов серы наиболее изучены SO2 - оксид серы IV (сернистый ангидрид) и SO3 -оксид серы VI (ангидрид серной кислоты).
Оксид серы(IV) SO2 природе встречается в составе вулканических газов и газов, образованных в результате горения природного угля. SO2 — газ с полярной ковалентной связью. В лабораторных условиях SO2 получают путем воздействия на соли сернистой кислоты соляной и серной кислотами:
Na2SO3 + H2SO4 = Na2SO4 + Н2О + SO2↑.
Оксид cepы (IV) получают также путем воздействия на медную стружку концентрированной серной кислотой:
2H2SO4(конц.) + Сu = CuSO4 + SO2↑ + 2Н2О.
В промышленности оксид серы (IV) получают путем обжига на воздухе сульфидов металлов:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2↑; 2ZnS + 3O2 → 2ZnO + 2SO2↑.
Оксид серы (IV)-бесцветный газе резким удушливым запахом, который при -10°С переходит в жидкое, а при -730C — в твердое состояние. Будучи кислотным оксидом, растворяясь в воде, образует сернистую кислоту:
SO2 + Н2О = H2SO3
Взаимодействуя с основными оксидами и щелочами, оксид cepы(IV) образует сульфиты:
СаО + SO2 = CaSO3; 2NaOH + SO2 → H2O + Na2SO3.
Оксид cepы(IV) окисляется в присутствии катализатора и образует оксид cepы(VI): 2SO2 + O2  2SO3 + Q.
2SO3 + Q.
Оксид cepы(IV) окисляет сульфид водорода, в результате сам восстанавливается до серы: 2H2S + SO2 → 2H2O + 3S↓.
SO2 обесцвечивает органические красители, убивает микроорганизмы, используется при изготовлении сухофруктов (кураги), выращивании ягод. Жидкий SO2 используется при очистке нефти.
Оксид серы (VI) SO3 — высший оксид серы, бесцветная жидкость, кипящая при 45°С, а при 17°С превращающаяся в белую кристаллическую массу. Оксид cepы(VI) проявляет свойства, присущие кислотным оксидам. Легко вступает в реакцию с водой и образует серную кислоту: SO3 + Н2О = H2SO4 + Q.
Сам оксид серы(VI) также хорошо растворяется в концентрированной серной кислоте, при этом образуется олеум: H2SO4 · nSO3:
H2SO4 + nSO3 → H2SO4 · nSO3.
В промышленности оксид серы (VI) получают путем окисления оксида cepы(IV) в присутствии катализатора. Оксид серы (VI) применяется в основном в производстве серной кислоты.
 2018-01-21
2018-01-21 2600
2600
