Фториды серы - соединения серы с фтором: SF6, SF4, S2F10 – имеют практическое значение.
Сера шестифтористая (гексафторид серы, SF6), бесцветный газ без запаха. Мало растворима в воде несколько лучше в спирте. При нагревании в кислороде или водороде не изменяется, но сероводородом разлагается на HF и S. Образуется при сжигании S во F2. Служит газообразным изолятором для высоковольтных установок (т. н. элегаз).
Сера пятифтористая (S2F10) - бесцветная жидкость. По химическим свойствам похожа на SF6, но отличается меньшей инертностью и очень ядовита. С CCl2 даёт фторохлорид SF5CI. Образуется при взаимодействии элементов в качестве примеси к SF6.
Сера четырёхфтористая (SF4) - бесцветный сильно ядовитый газ с резким запахом. Получают взаимодействием SCI2 с NaF или CoF3 с S. Реагируют с альдегидами, кетонами и другими карбонильными соединениями, образуя соответствующие фторорганические соединения.
Тионилхлорид (хлористый тионил) SOCl2 — хлорангидрид сернистой кислоты. Относится к тионилгалогенидам.
Тионилхлорид — бесцветная дымящаяся на воздухе жидкость с удушающим запахом. Молекула тионилхлорида имеет пирамидальное строение.
При нагревании выше температуры кипения тионилхлорид начинает разлагаться с образованием S2Cl2, SO2, Cl2. Выше 440 °C наблюдается полный распад соединения.
В воде разлагается на диоксид серы и хлороводород.
Применяется в органическом синтезе в качестве хлорирующего агента, например, для получения хлорангидридов карбоновых кислот и алкилгалогенидов.
В промышленности тионилхлорид получают прямым взаимодействием серы, кислорода, хлора при 180—200 °C (с использованием в качестве катализатора активного угля).
Сульфурилхлорид (хлористый сульфурил) SO2Cl2 — хлорангидрид серной кислоты.
Бесцветная, резко пахнущая жидкость, хорошо растворимая в хлороформе и уксусной кислоте, в избытке воды растворяется с частично протекающим гидролизом. Дымит на воздухе. Гидролиз идёт слабо в холодной воде, в горячей воде протекает быстро. При хранении желтеет, поскольку распадается на SO2 и зеленовато-жёлтый хлор.
Получают взаимодействием SO2 с Cl2 в присутствии катализаторов (активированный уголь).
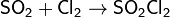
Хлорсульфо́новая кислота, HSO3Cl — монохлорангидрид серной кислоты, бесцветная, дымящая на воздухе и резко пахнущая жидкость.
Хлорсульфоновая кислота не образует солей. При взаимодействии с водой происходит бурная экзотермическая реакция с гидролизом хлорсульфоновой кислоты на серную кислоту и хлороводород.
С органическими соединениями хлорсульфоновая кислота взаимодействует, образуя, в зависимости от условий,сульфоновые кислоты или их хлориды.
Применяется в качестве сульфурирующего агента в органической химии.
Получают хлосульфоновую кислоту непосредственно при взаимодействии хлороводорода с оксидом серы(VI):
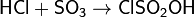
 2018-01-21
2018-01-21 2426
2426








