ЛЕКЦИЯ 7. РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ ПО СКОРОСТЯМ
При выводе основного уравнения МКТ мы пренебрегли столкновением молекул между собой и ввели среднюю квадратичную скорость. Тем самым мы заменили реальный закон распределения молекул по скоростям предположением, что у всех молекул одинаковые скорости движения. На самом деле это, конечно, не так. Даже в состоянии термодинамического равновесия молекулы имеют разные скорости хотя бы из-за столкновений друг с другом. Напомним, что равновесным состоянием называется такое состояние, в котором термодинамические параметры, характеризующие систему, имеют определённые значения, не изменяющиеся с течением времени. При более детальном рассмотрении равновесных состояний нам необходимо каким-то образом учитывать столкновения молекул между собой. Потому что как раз через столкновения молекул устанавливается равновесное значение термодинамических параметров системы. Например, если сосуд с газом, имеющим температуру Т 1, поставить на нагреватель, а затем снять с него, то по истечении некоторого времени мы обнаружим, что температура всего газа будет Т 2, хотя мы нагревали только дно сосуда. Причем Т 2 > Т 1. В результате столкновений молекул друг с другом в сосуде устанавливается новое равновесное состояние с температурой Т 2. Более «горячие» молекулы, которые обладают большей кинетической энергией, при столкновениях отдают избыток энергии другим, «холодным» молекулам. После серии столкновений среднее значение кинетической энергии молекул станет одинаковым во всем сосуде, а это и означает, что установилось новое равновесное состояние.
Чтобы доказать, что именно столкновения молекул между собой играют определяющую роль при установлении термодинамического равновесия, приведём следующий численный пример. При нормальном атмосферном давлении и комнатной температуре в 1 (м 3 ) воздуха содержится около 10 25 молекул. Среднее расстояние между молекулами по порядку величины будет равно  . Это почти на 2 порядка больше размеров молекул и расстояний, на которых молекулы взаимодействуют между собой. Другими словами, воздух действительно можно считать идеальным газом. Подсчитаем теперь суммарную площадь всех молекул в 1 (м 3 ). Будем считать молекулы сферами с диаметром в d ~10 -10 (м). Тогда поверхность всех молекул, заключённых в одном кубометре воздуха, будет, очевидно, равна произведению поверхности шара
. Это почти на 2 порядка больше размеров молекул и расстояний, на которых молекулы взаимодействуют между собой. Другими словами, воздух действительно можно считать идеальным газом. Подсчитаем теперь суммарную площадь всех молекул в 1 (м 3 ). Будем считать молекулы сферами с диаметром в d ~10 -10 (м). Тогда поверхность всех молекул, заключённых в одном кубометре воздуха, будет, очевидно, равна произведению поверхности шара 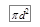 на число всех молекул 1025 (м- 3 ): 1025· p ·10-20» p 105 (м 2 ). Другими словами, мы получили, что суммарная поверхность молекул в 100 000 раз больше, чем поверхность 1 (м- 3 )! Следовательно, молекулы сталкиваются между собой гораздо чаще, чем со стенками сосуда. И именно столкновения между молекулами играют определяющую роль при установлении равновесных состояний. Но при этом скорости у молекул будут самые разные. Теперь попытаемся найти распределение молекул по скоростям.
на число всех молекул 1025 (м- 3 ): 1025· p ·10-20» p 105 (м 2 ). Другими словами, мы получили, что суммарная поверхность молекул в 100 000 раз больше, чем поверхность 1 (м- 3 )! Следовательно, молекулы сталкиваются между собой гораздо чаще, чем со стенками сосуда. И именно столкновения между молекулами играют определяющую роль при установлении равновесных состояний. Но при этом скорости у молекул будут самые разные. Теперь попытаемся найти распределение молекул по скоростям.
 2014-02-02
2014-02-02 965
965