Окислительно-восстановительный потенциал (редокс-потенциал от англ. redox — red uction- ox idation reaction, Eh или Eh) — мера способности химического вещества присоединять электроны (восстанавливаться[1]). Окислительно-восстановительный потенциал выражают в милливольтах (мВ). Примером окислительно-восстановительного электрода являются: Pt/Fe3+,Fe2+
Определение величины редокс-потенциала
Окислительно-восстановительный потенциал определяют как электрический потенциал, устанавливающийся при погружении платины или золота (инертный электрод) в окислительно-восстановительную среду, то есть в раствор, содержащий каквосстановленное соединение (Ared), так и окисленное соединение (Aox). Если полуреакцию восстановления представить уравнением:
Aox + n·e− → Ared,
то количественная зависимость окислительно-восстановительного потенциала от концентрации (точнее активностей) реагирующих веществ выражается уравнением Нернста.
Окислительно-восстановительный потенциал определяют электрохимическими методами с использованием стеклянного электрода с red-ox функцией[2] и выражают в милливольтах (мВ) относительно стандартного водородного электрода в стандартных условиях
|
|
|
.
Способность восстановителя отдавать электроны окислителю выражается величиной окислительно-восстановительного потенциала (стандартного восстановительного потенциала), или редокс — потенциала. Редокс — потенциал определяют измерением электродвижущей силы (э. д. с.) в вольтах, возникающей в полуэлементе, в котором восстановитель и окислитель, присутствующие в концентрациях равных 1 моль/литр при 25°С и рН 7,0 находятся в равновесии с электродом, способным принимать электроны от восстановителя и передавать их окислителю. В качестве стандарта принят редокс-потенциал реакции Н2 → 2Н+ + 2е, который при давлении газообразного водорода в 1 атмосферу при концентрации ионов Н+ равной 1 моль/литр (что соответствует рН = 0) и при 25°С условно принят за нуль. В условиях значения рН, принятого в качестве стандарта при биохимических расчетах, то есть при рН 7,0, редокс-потенциал (Е°´) водородного электрода (системы Н2 / 2Н+) равен -0,42 В.
Система с более отрицательным редокс-потенциалом обладает большей способностью отдавать электроны системе с более положительным редокс-потенциалом. Например, пара НАД • Н / НАД+, редокс-потенциал которой равен -0,32 В будет отдавать свои электроны окислительно-восстановительной паре флавопротеин (восстановл.) / флавопротеин (окислен.), имеющей потенциал −0,12 В, то есть более положительный. Большая положительная величина редокс-потенциала окислительно-восстановительной пары вода/кислород (+0,82 В) указывает на то, что у этой пары способность отдавать электроны (то есть способность образовывать молекулярный кислород) выражена очень слабо. Иначе можно сказать, что у молекулярногокислорода очень велико сродство к электронам или водородным атомам.
|
|
|
Уравнение Нернста
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
Вывод уравнения Нернст  ,
,
растворов.,
где
·  — электродный потенциал,
— электродный потенциал,  — стандартный электродный потенциал, измеряется в вольтах;
— стандартный электродный потенциал, измеряется в вольтах;
·  — универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
— универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
·  — постоянная Фарадея, равная 96485,35 Кл·моль−1;
— постоянная Фарадея, равная 96485,35 Кл·моль−1;
· 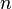 — число молей электронов, участвующих в процессе;
— число молей электронов, участвующих в процессе;
·  и
и  — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
Если в формулу Нернста подставить числовые значения констант  и
и  и перейти от натуральных логарифмов к десятичным, то при
и перейти от натуральных логарифмов к десятичным, то при  получим
получим

Билет 49 вопрос 2
 2018-01-21
2018-01-21 6481
6481

 —
— 






