Электрон в настоящее время не рассматривается как материальная точка. Атомные частицы обладают одновременно и корпускулярными, и волновыми свойствами.
Луи де Бройль первым предположил и доказал, что двойственность присуща электрону, как и другим микрочастицам.
масса m, скорость v, импульс 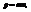 длина волны
длина волны 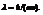 h-постоянная Планка
h-постоянная Планка 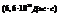
Волновые свойства: дифракция и интерференция – свойства, характерные дивжению волны.
Корпускулярные свойства: электрон действует как частица, как единое целое. Движение – пульсирующее.
s- электронные облака обладают шаровой симметрией, p- облака – вид гантели (знак бесконечности).
___________________________________________
С остояние любого электрона в атоме может быть охарактеризовано набором 4 квантовых чисел: n, l, m, s.
Главное квантовое число характеризует общий уровень энергии электрона. Принимает значения от 1 до 7 (соответствуют буквенным обозначениям: k,l,m,n,o,p,q). 1-й слой – ближайший к ядру слой.
Электронные уровни подразделяются на подуровни. Электроны одного и того же подуровня различны по величине момента количества движения mvr (m – масса, v - скорость на орбите, r – радиус орбиты). Число подуровней равно числу уровней (максимальное число подуровней – 4).
Побочное (орбитальное) квантовое число характеризует энергетическое состояние электрона на подуровне (l=n-1).
Магнитное к.ч. определяет ориентацию электронного облака в пространстве (+3, +2, +1, 0, -1, -2, -3).
Спиновое к.ч. характеризует направление вращения электрона. (+1/2 и -1/2).
Наибольшее число электронов на подуровне вычисляется по формуле 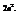 Таким образом, максимальное число – 32.
Таким образом, максимальное число – 32.
Распределение электронов по уровням и подуровням изображается с помощью электронных формул или ячеек. Пример: 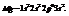
 2018-01-21
2018-01-21 1214
1214








