Период – последовательность атомов с одинаковым числом электронных слоев.
Большие периоды содержать 2 ряда (четный и нечетный). Периоды начинаются с активного металла, по мере продвижения усиливаются неметаллические свойства, а завершаются галогеном и инертным газом. Элементы, которые как бы осуществляют переход от металлов к неметаллам, носят название переходных.
Радиус атома -расстояние между атомным ядром и самой дальней из стабильных орбит электронов в электронной оболочке этого атома.
Увеличивается с увеличением порядкового номера элемента.
Энергия ионизации – энергия, которую необходимо затратить на отрыв электрона с нормального уровня и удаление его на бесконечно далекий уровень. Атом при этом превращается в положительный ион.
Ее можно считать мерой металличности: чем меньше энергия, тем ярче проявляются металлические свойства, и наоборот.
Энергия сродства к электрону – энергия, которая выделяется при присоединении электрона к нейтральному атому. Она очень мала и становится более-менее заметной с элементов 5-й группы.
Электроотрицательность – сумма энергии ионизации и энергии сродства. Чем она больше, тем вероятнее превращение атомов в отрицательные ионы. 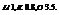
Образование химической связи. Энергия связи и длина связи.
При взаимодействии атомов между ними может возникнуть химическая связь, приводящая к образованию молекулы/иона/кристалла. Чем прочнее связь, тем больше требуется затратить энергии на ее разрыв.
При возникновении связи энергия выделяется, следовательно уменьшается потенциальная энергия системы электронов и ядер.
 2018-01-21
2018-01-21 1989
1989
