1й уровень
1. Средняя скорость гомогенной реакции выражается формулой:
а) 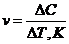
| б) 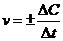
| в) 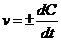
| г) 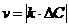
|
2. Математическая зависимость скорости реакции от температуры описывается уравнением:
а) 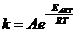
| б) 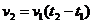
| в) 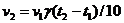
| г) 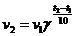
|
3. Изменение концентрации реагирующих веществ в единицу времени называется..
а) скоростью химической реакции.
б) константой равновесия химической реакции.
в) константой скорости химической реакции.
г) изменением плотности химической реакции.
4. Выражение закона действующих масс
д) 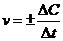
| е) 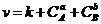
| ж) 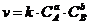
| з) 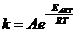
|
5. Энергия активации измеряется в:
| а) Дж/л. | б) кДж/л. | в) кДж/моль. | г) кДж/мольК. |
6. Температурный коэффициент скорости химической реакции принимает значения:
а)2, 3, 4. б)-2, -1, 0, +1, +2. в)изменяется от 2х до 4х.
г)изменяется от 2х до 8и. г)изменяется от -1/2 до + 1/2.
7. Измельчение твердого вещества скорость химической реакции
| а) уменьшает. | б) увеличивает. | в) не изменяет. | г) замедляет. |
8. Катализатор скорость химической реакции:
| а)не изменяет | б)увеличивает | в)уменьшает | г)замедляет | д)периодически влияет |
9. Скорость химической реакции при увеличении концентрации реагирующих веществ:
| а)уменьшается | б)увеличивается | в)не изменяется | г)изменяется периодически |
10. Скорость химической реакции зависит от:
| а)температуры | б)цвета вещества | в)катализатора | г)формы реактора | д)природы вещества |
2-й уровень
11. Скорость химической реакции зависит от…
а)концентрации продуктов реакции. б)концентрации исходных веществ.
в)температуры. г)природы исходных веществ.
д)природы конечных веществ. е)присутствия ингибиторов или катализаторов.
12. В уравнении VСР = ±DС/Dt выбирают знак минус, если скорость реакции вычисляют…
а) по изменению концентрации исходного вещества.
б) по изменению концентрации продукта реакции.
в) по изменению площади поверхности реагирующих веществ.
г) по изменению температуры при протекании реакции.
13. Энергия активации обозначена цифрой на энергетической диаграмме
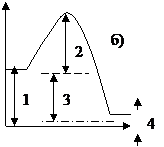
| а) 1. | б) 2. | в) 3. | г) 4. |
14. Катализатор изменяет скорость реакции, потому что…
а) удаляет продукты реакции.
б) взаимодействует с реагирующими веществами, изменяя энергию активации.
в) изменяет температурный коэффициент реакции.
г) смещает положение равновесия в сторону прямой реакции.
15. Температурный коэффициент показывает:
а) во сколько раз изменится скорость реакции при повышении температуры на 100.
б) во сколько раз изменяется концентрация при повышении температуры на 100.
в) во сколько раз увеличивается время протекании реакции при повышении температуры на 100.
г) на сколько градусов изменяется температура при протекании реакции.
16. Величина 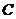 в выражении
в выражении 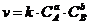 обозначает
обозначает
| а)температуру. | б)давление. | в)концентрацию вещества. | г)скорость реакции. |
17. Математическое выражение закона действующих масс для скорости реакции
4NH3(Г) + 3O2(Г) " 6H2O(Г) + 2N2(Г).
а) 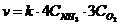
| б) 
| в) 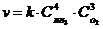
| г) 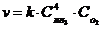
|
18. Ингибиторы - это вещества, которые
а)увеличивают скорость реакции. б)уменьшают скорость реакции.
в)не изменяют скорость реакции. г)увеличивают концентрации веществ.
д)уменьшают концентрации веществ.
19. Константа скорости реакции 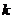 зависит от
зависит от
а)температуры. б)давления. в)концентрации исходных веществ.
г)концентрации продуктов реакции. д)присутствия ингибиторов.
е)присутствия катализаторов.
20. Порядок реакции - это сумма показателей степеней в
а)уравнении Аррениуса. б) уравнении Вант-Гоффа.
в) выражении закона действующих масс. г) выражении Больцмана.
21. Константа скорости химической реакции равна скорости химической реакции при …
а)стандартной температуре. б) стандартных концентрациях реагирующих веществ.
в)условии необратимости процесса. г) стандартном давлении и температуре.
д)стандартном изменении энергии Гиббса.
22. Скорость обратной химической реакции
CaCO3(Т) D CaO(Т) + CO2(Г):
а) 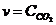
| б) 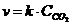
| в) 
| г) 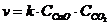
| д) 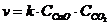
|
23. Активные молекулы обладают
а)избыточной энергией. б)повышенной скоростью движения.
в)большой вероятностью столкновения. г)способностью ускорять реакцию.
3-й уровень
24. Соответствие между уравнениями реакций и формулами скорости
| 1. | A + B " D | а) | 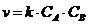
| |
| 2. | 2A + B " D | б) | 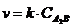
| |
| 3. | 2A + 2B " 2D | в) | 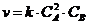
| |
| 4. | A2B " P + D | г) | 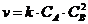
| |
| д) | 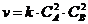
|
25. Выражение для скорости 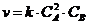 соответствует реакции
соответствует реакции
| а)A + B " C | б)2A + B " C | в)A + 2B " C | г)2A + 2B " 2C | д)A2B " C + D |
26. Соответствие между словами и их математическими выражениями:
| а) | Закон действующих масс | 1) | 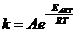
| |
| б) | Уравнение Вант-Гоффа | 2) | 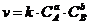
| |
| в) | Уравнение Аррениуса | 3) | 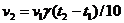
| |
| г) | скорость химической реакции | 4) | 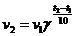
| |
| 5) | 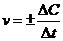
|
27. Предэкспоненциальный множитель в уравнении Аррениуса
а) показывает долю активных столкновений.
б) равен константе скорости реакции при стандартных условиях.
в) равен максимально возможной константе скорости при данной температуре.
г) равен энергии активации.
28. Закон действующих масс строго соблюдается для … реакций
а)гетерогенных б)последовательных
в)параллельных. г)гомогенных
4-й - 5-й уровень
29. Избыточная энергия, которую нужно сообщить молекулам для того, чтобы ввести их во взаимодействие, называется …энергия активации
30. Скорость реакции увеличится в …. раз при повышении температуры на 200 (температурный коэффициент равен 3)
а)увеличилась в 9 раз. б)уменьшилась в 9 раз. в)увеличилась в 6 раз.
г)величится в 60 раз. д)увеличится в 27 раз.
31. Скорость прямой реакции CO2(Г) + СТВ " 2CO(Г) изменится ….. раз при увеличении давления в 2 раза.
а)увеличится в в 4 раза. б)увеличится в 16 раз.
в)увеличится в 2 раза. г)уменьшится в 2 раза.
32. Скорость обратной реакции CO2(Г) + СТВ " 2CO(Г), изменится в …. раз при увеличении давление в 2 раза.
а)увеличится в в 4 раза. б)увеличится в 16 раз.
в)увеличится в 2 раза. г)уменьшится в 2 раза.
33. Правило Вант-Гоффа: при повышении температуры на 100С скорость химической реакции увеличивается в 2-4 раза
34. Скорость прямой реакции CO(Г) + Cl2(Г) D COCl2(Г) ….. если объем газовой смеси уменьшить в 2 раза?
а)уменьшится в 2 раза. б)уменьшится в 4 раза.
в)увеличится в 2 раза. г)увеличится в 4 раза.
д)не изменится.
35. Скорость реакции … если понизить температуру на 400С (температурный коэффициент скорости g = 2).
а)увеличится в 8 раз. б)уменьшится в 8 раз.
в)увеличится в 16 раз. г)уменьшится в 16 раз.
36. Константа скорости реакции PCl3(Г) + Cl2(Г) D PCl5(Г) изменится при
а)увеличении давления в 2 раза. б)уменьшении объема в 2 раза.
в)увеличении концентрации PCl3. г)повышении температуры.
д)увеличении перемешивания.
 2018-01-21
2018-01-21 1597
1597
