1й уровень
1. Смещение положение химического равновесия описывает:
а)закон сохранения массы веществ М.В.Ломоносова.
б)принцип Ле-Шателье. б)периодический закон Д.И.Менделеева.
в)правило Вант-Гоффа. г)уравнение Аррениуса.
д)1-й закон термодинамики.
2. Положение химического равновесия зависит от
а)температуры. б)концентрации реагирующих веществ
в)цвета веществ. в)перемешивания.
г)катализатора. д)индикатора.
3. Обратимая реакция
а)A + B = AB. б)A + B " AB. в)A + B! AB. г)A + B D AB.
4. Химическое равновесие - это такое состояние системы, когда
а) скорость прямой реакции больше скорости обратной реакции.
б) скорость прямой реакции меньше скорости обратной реакции.
в) скорость прямой реакции равна скорости обратной реакции.
г) реакция необратима.
5. Реакции, в результате протекания которых выпадает осадок, выделяется газ или образуется малодиссоцирующее вещество, называются
| а)обратимыми. | б)необратимыми. | в)равновесными. | г)неравновесными |
6. Общий вид выражения для константы равновесия:
а) 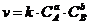
| б) 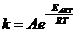
| в) 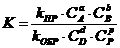
| г) 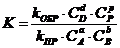
| д) 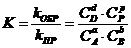
|
7. Совокупность однородных (по химическим и физическим свойствам) частей системы называется …
| а) энтропией. | б) энтальпией. | в) структурой. | г) фазой. | д) раствором. |
8. Правило фаз Гиббса:
а) 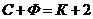 . .
| б) 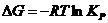 . .
| в)  . .
| г) 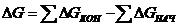
|
9. Положение химического равновесия зависит от:
| а)температуры | б)концентрации реагирующих веществ | в)цвета веществ | г)перемешивания |
| д)катализатора | е)индикатора |
10. Смещение положение химического равновесия описывает:
а)закон сохранения массы веществ М.В.Ломоносова.
б)принцип Ле-Шателье. в)периодический закон Д.И.Менделеева.
г)правило Вант-Гоффа. д)уравнение Аррениуса.
е)1-й закон термодинамики.
2-й уровень
11. Изменение энергии Гиббсса связано с константой равновесия соотношением:
а) 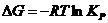
| б) 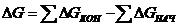
| в) 
| г) 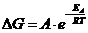
|
12. Константа равновесия системы CH4(Г) + CO2(Г) D 2CO(Г) + 2H2(Г) соответствует выражение
а) 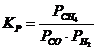
| б) 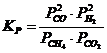
| в) 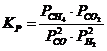
| г) 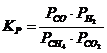
|
13. Термодинамическим условием равновесия системы A + B D AB является:
а) 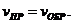
| б) 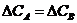 . .
| в) 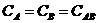
| г) 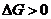
| д) 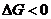
| е) 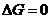
|
14. Кинетическое условие равновесия системы A + B D AB:
а) 
| б) 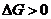
| в) 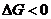
| г) 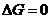
| д) 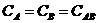
| е) 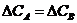
|
15. Состояние равновесия показано на рисунке;




16. Принцип Ле-Шателье: если на систему, которая находится в состоянии равновесия, оказать внешнее воздействие, то положение равновесия …
а) сместится в сторону той реакции, которая ослабляет это воздействие.
б) сместится в сторону той реакции, которая усиливает это воздействие.
в) сместится в сторону прямой реакции.
г) сместится в сторону обратной реакции.
д) система не будет отзываться на оказываемое воздействие.
17. Положение равновесия смещено в сторону…,при KP > 1
а) прямой реакции.
б) обратной реакции.
в) равновесной реакции.
г) обратимой реакции.
18. Положение равновесия смещено в сторону…при KP < 1
а) прямой реакции.
б) обратной реакции.
в) равновесной реакции.
г) обратимой реакции.
3-й уровень
19. Константа равновесия системы CH4(Г) + CO2(Г) D 2CO(Г) + 2H2(Г)
а) 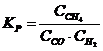
| б) 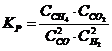
| в) 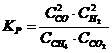
| г) 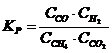
|
20. Увеличение концентрации NO2 способствует смещению положения равновесия системы 2NO2 D 2NO + O2
а) в сторону обратной реакции.
б) в сторону прямой реакции.
в) не сместит равновесие.
г) увеличит количество образующихся веществ.
д) уменьшит количество образующихся веществ.
21. Положение равновесия системы 2NO2(Г) D 2NO(Г) + O2(Г) зависит от
а) давления.
б) добавления катализатора.
в) увеличения концентрации NO2.
г) изменения температуры.
22. Увеличение температуры вызовет смещение равновесия системы
N2(Г) + O2(Г) D 2NO(Г); DH = 180 кДж/моль
а) в сторону обратной реакции.
б) в сторону прямой реакции.
в) не сместит равновесие.
г) увеличит количество образующихся веществ.
д) уменьшит количество образующихся веществ.
23. Выражение константы равновесия системы 2H2S(Г) D 2H2(Г) + S2(Т):
а) 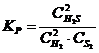
| б) 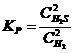
| в) 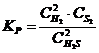
| г) 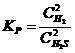
|
24. Установите соответствие между обозначениями в формуле 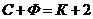
| а) С | 1) концентрация. | |
| б) Ф | 2) число степеней свободы системы. | |
| в) К | 3) физическая постоянная. | |
| г) 2 | 4) число фаз в системе. | |
| 5) элемент калий. | ||
| 6) число компонентов. | ||
| 7) число влияющих внешних факторов. |
25. Соответствие между воздействием на систему H2(Г) + S(Т) D H2S(Г); DH < 0 и направлением смещения равновесия.
| 1) | повышение температуры. | а) | в сторону прямой реакции. | |
| 2) | уменьшение концентрации H2S. | б) | в сторону обратной реации. | |
| 3) | увеличение давления. | в) | положение равновесия не изменяется. | |
| г) | сера выпадает в осадок. |
26. Увеличение давления смещает положение равновесия влево в реакциях:
а) 2NO2(Г) D 2NO(Г) + O2(Г).
б) N2(Г) + O2(Г) D 2NO(Г).
в) CH4(Г) + CO2(Г) D 2CO(Г) + 2H2(Г).
г) C(Т) + O2(Г) D CO2(Г).
д) O2(Г) + 4HCl(Г) D 2H2O(ПАР) + 2Cl2(Г).
27. Уменьшение давления НЕ смещает положение равновесия:
а) 2NO2(Г) D 2NO(Г) + O2(Г).
б) N2(Г) + O2(Г) D 2NO(Г).
в) CH4(Г) + CO2(Г) D 2CO(Г) + 2H2(Г).
г) C(Т) + O2(Г) D CO2(Г).
д) O2(Г) + 4HCl(Г) D 2H2O(ПАР) + 2Cl2(Г).
28. Можно сместить положение равновесия системы N2(Г) + O2(Г) D 2NO(Г); DH = 180 кДж, в ту же сторону, что и повышение температуры:
а) понижением давления.
б) повышением давления.
в) повышением концентрации NO.
г) понижением концентрации NO.
29. Если на систему, находящуюся в состоянии равновесия оказать внешнее воздействие, то равновесие сместится в сторону той реакции, которая ослабляет….оказанное воздействие.
30. Смещать влево положение равновесия системы
N2(Г) + O2(Г) D 2NO(Г); DH = 180 кДж будут
а)понижение давления. б)повышение давления.
в)понижение температуры. г)повышение температуры.
д)повышение концентрации NO. е)понижение концентрации NO.
31. Константа равновесия имеет вид 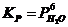 для системы:
для системы:
а) 3O2(Г) + 12HCl(Г) D 6H2O(ПАР) + 3Cl2(Г).
б) 6Cl2(Г) + 6H2O(Ж) D 6HCl(Ж) + 6HClO(Ж).
в) 6Na(Т) + 6H2O(Ж) D 6NaOH(Т) + 3H2(Г).
г) CaCl2×6H2O(Т) D CaCl2(Т) + 6H2O(ПАР).
32. Давление не будет изменять положение равновесия в системе:
а) N2(Г) + O2(Г) D 2NO(Г);
б) 3O2(Г) + 12HCl(Г) D 6H2O(ПАР) + 3Cl2(Г).
в) 2NO2(Г) D 2NO(Г) + O2(Г):
г) CH4(Г) + CO2(Г) D 2CO(Г) + 2H2(Г):
33. Положение равновесия системы MgCO3(Т) D MgO(Т) + CO2(Г); DH > 0 будет смещаться при повышении температуры
а)в сторону исходных веществ. б)в сторону продуктов реакции.
в)влево. г)не будет изменять своего положения.
4-й уровень
34. Константа равновесия системы 2NO2 D 2NO + O2 при равновесных концентрациях 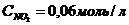 ,
, 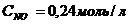 ,
,  равна
равна
а)0,1152. б)0,48. в)1,92. г)5,21.
35. Константа равновесия гомогенной системы A + B D 2С при равновесных концентрациях 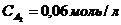 ,
, 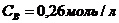 ,
, 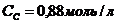 равна
равна
а)56,41. б)49,64. в)0,018. г)0,36. д)2,42.
Строение атома
1-й уровень
1. Атом состоит из ядра и …
| а)электронной оболочки. | б)протонной оболочки. | в)молекулярной оболочки. | г)нейтронной оболочки. |
2. Атом состоит из:
а) незаряженного ядра и электронной оболочки.
б) незаряженного ядра и нейтронной оболочки.
в) положительно заряженного ядра и электронной оболочки.
г) положительно заряженного ядра и молекулярной оболочки.
3. В состав атомного ядра входят…
| а)протоны и электроны. | б)протоны и нейтроны. | в)нейтроны и электроны. | г)протоны и электроны |
4. Квантовые числа
| а)l. | б)mS. | в)h. | г)l. | д)n. | е)j. |
5. Наибольшее число электронов на энергетическом уровне:
|
6. Электрон обозначается
| а)p. | б)n. | в)e. | г)n. |
7. Протон обозначается
| а)p. | б)n. | в)e. | г)n. |
8. Атомное ядро состоит из …
| а)протоны и электроны. | б)протоны и нейтроны. | в)нейтроны и электроны. | г)протоны и электроны |
9. Верным является утверждение:
а) масса протона равна массе нейтрона и равна массе электрона.
б) масса протона равна массе нейтрона и во много раз больше массы электрона.
в) масса протона равна массе электрона.
г) масса нейтрона равна массе электрона и во много раз меньше массы протона.
2-й уровень
1. Атомной орбиталью называется …
а) траектория около ядра, по которой движется электрон.
б) область пространства около ядра, в которой располагается траектория движения электрона.
в) область пространства около ядра, в которой большая вероятность нахождения электрона.
г) область пространства около ядра, в которой вероятность нахождения электрона равна 90%.
2. Главное квантовое число «n» характеризует…
а) вращение электрона вокруг собственной оси и собственный магнитный момент движения электрона.
б) ориентацию атомной орбитали в пространстве и ее магнитный момент.
в) энергию электронного слоя (уровня), размер и плотность атомных орбиталей.
г) форму атомной орбитали и орбитальный момент движения электрона.
3. Орбитальное квантовое число «l» характеризует…
а) вращение электрона вокруг собственной оси и собственный магнитный момент движения электрона.
б) ориентацию атомной орбитали в пространстве и ее магнитный момент.
в) энергию электронного слоя (уровня), размер и плотность атомных орбиталей.
г) форму атомной орбитали и орбитальный момент движения электрона.
4. Магнитное квантовое число «ml» характеризует …
а) вращение электрона вокруг собственной оси и собственный магнитный момент движения электрона.
б) ориентацию атомной орбитали в пространстве и ее магнитный момент.
в) энергию электронного слоя (уровня), размер и плотность атомных орбиталей.
г) форму атомной орбитали и орбитальный момент движения электрона.
5. Спиновое квантовое число «mS» характеризует …
а) вращение электрона вокруг собственной оси и собственный магнитный момент движения электрона.
б) ориентацию атомной орбитали в пространстве и ее магнитный момент.
в) энергию электронного слоя (уровня), размер и плотность атомных орбиталей.
г) форму атомной орбитали и орбитальный момент движения электрона.
6. Принцип Паули:
а) В атоме не может быть двух электронов, обладающих одинаковым набором квантовых чисел.
б) Суммарное спиновое число электронов на подуровне должно быть наибольшим.
в) Электроны заполняют орбитали по возрастанию сумму главного и орбитального квантовых чисел (n + l); при равных суммах заполняется орбиталь с меньшим значением главного квантового числа.
г) Наибольшей устойчивость обладают орбитали, заполненные полностью или наполовину.
7. Принцип Гунда:
а) В атоме не может быть двух электронов, обладающих одинаковым набором квантовых чисел.
б) Суммарное спиновое число электронов на подуровне должно быть наибольшим.
в) Электроны заполняют орбитали по возрастанию сумму главного и орбитального квантовых чисел (n + l); при равных суммах заполняется орбиталь с меньшим значением главного квантового числа.
г) Наибольшей устойчивость обладают орбитали, заполненные полностью или наполовину.
8. Орбитальное квантовое число принимает значения:
| а)от –l через 0 до +l. | б)от 0 до (n – 1). |
| в)+1/2 и -1/2. | г)0, 1, 2, 3, ….¥. |
| д)1, 2, 3, ….¥. |
9. Магнитное квантовое число принимает значения:
| а)от –l через 0 до +l. | б)от 0 до (n – 1). |
| в)+1/2 и -1/2. | г)0, 1, 2, 3, ….¥. |
| д)1, 2, 3, ….¥. |
10. Спиновое квантовое число принимает значения:
| а)от –l через 0 до +l. | б)от 0 до (n – 1). |
| в)+1/2 и -1/2. | г)0, 1, 2, 3, ….¥. |
| д)1, 2, 3, ….¥. |
11. На 2-м энергетическом уровне существуют подуровни:
| а)p; | б)d; | в)s; | г)f. |
12. Заполнению подуровня по правилу Гунда соответствует электронно-графических формул:
а)
| б)
| в)
| г)
|
3-й уровень
1. Последовательность возрастания энергии подуровней
| 1)4s | 2)4d | 3)4f | 4)4p |
2. Соответствие между обозначением подуровня и числом атомных орбиталей на нем:
| Обозначение подуровня | Число атомных орбиталей | ||||
| а)5 | d | 1) | |||
| б)7 | f | 2) | |||
| в)2 | s | 3) | |||
| г)3 | p | 4) |
3. По правилу Клечковского заполнение атомных орбиталей происходит по возрастанию суммы …
а) магнитного и главного квантового чисел.
б) орбитального и главного квантового чисел.
в) орбитального и магнитного квантового чисел.
г) главного и спинового квантовых чисел.
4. Максимально возможное число электронов на уровне с главным квантовым число 3 равно:
| а)32 | б)18 | в)8 | г)2 |
5. Соответствие между обозначением орбитального квантового числа и его значением:
| а) | d | 1) | ||
| б) | s | 2) | ||
| в) | f | 3) | ||
| г) | p | 4) | ||
| 5) |
6. Соответствие между формой электронного облака и значением квантового числа:
| а) | «объемный бантик» | 1) | ||
| б) | сфера | 2) | ||
| в) | гантелеобразная | 3) | ||
| 4) | ||||
| 5) |
7. 6s-подуровень заполняется раньше…., чем 4f.
8. Сумма (n + l) у подуровня 6s меньше…., чем у подуровня 5d. Этот подуровень заполняется раньше ….
4-й уровень
1. Электронная формула атома фосфора (порядковый номер 15):
| а)1s22s22p63s23p3. | б)1s22s22p63s13p4 |
| в)1s22s22p43s23p5 | г)1s22s22p63s33p2. |
2. Электронная формула атома железа (число электронов 26)
| а)1s2 2s2 2p6 3s2 3p6 3d5 4s2 | б)1s2 2s2 2p6 3s2 3p6 4s2 3d5 4p1 |
| в)1s2 2s2 2p6 3s2 3p6 4s1 3d6 4p1 | г)1s2 2s2 2p6 3s2 3p6 4s2 3d6 4p0 |
3. По электронной формуле иона определите заряд ядра его атома:
Э+4 = [Ar] (порядковый номер аргона - 18):
| а)22 | б)20 | в)18 | г)16 |
4. Какая из приведенных формул соответствует иону Fe+2:
| а)1s2 2s2 2p6 3s2 3p6 3d5 4s0 | б)1s2 2s2 2p6 3s2 3p6 4s0 3d5 4p1 |
| в)1s2 2s2 2p6 3s2 3p6 4s0 3d6 4p0 | г)1s2 2s2 2p6 3s2 3p6 4s2 3d6 4p0 |
 2018-01-21
2018-01-21 856
856