1. Азот имеет степень окисления +3 в соединении
а)NH3. б)N2. в)HNO2. г)HNO3.
2. Азот имеет степень окисления 0 в соединении
а)NH3. б)N2. в)HNO2. г)HNO3.
3. Азот имеет степень окисления -3 в соединении
а)NH3. б)N2. в)HNO2. г)HNO3.
4. Азот имеет степень окисления +5 в соединении
а)NH3. б)N2. в)HNO2. г)HNO3.
5. Сера имеет степень окисления 0 в соединении
а)H2S. б)S. в)H2SO3. г)H2SO4. д)H2S2O7.
6. Сера имеет степень окисления +4 в соединении
а)H2S. б)S. в)H2SO3. г)H2SO4. д)H2S2O7.
7. Сера имеет степень окисления +6 в соединениях
а)H2S. б)S. в)H2SO3. г)H2SO4. д)H2S2O7.
8. Сера имеет степень окисления -2 в соединении
а)H2S. б)S. в)H2SO3. г)H2SO4. д)H2S2O7.
9. Азот N2 в реакции N2 + 3H2 " 2NH3 является
а)окислителем. б)восстановителем. в)соединителем. г)заместителем.
10. Водород H2 в реакции N2 + 3H2 " 2NH3 является
а)окислителем. б)восстановителем. в)соединителем. г)заместителем.
11. Цинк Zn в реакции Zn + 2HCl " ZnCl2 + H2# является
а)окислителем. б)восстановителем. в)соединителем. г)заместителем.
12. Окислителем в реакции Zn + 2HCl " ZnCl2 + H2# является
а)Zn. б)HCl. в)Zn2+. г)H2#. д)H+. е)Cl-.
13. Окислителем в реакции 2H2S + 3O2 " 2SO2 + 2H2O является
а)H2S. б)O2. в)H+. г)S-2. д)S+4. е)SO2.
14. Восстановителем в реакции 2H2S + 3O2 " 2SO2 + 2H2O является
а)O2. б)H+. в)S-2. г)S+4. д)SO2.
15. Окислителем в реакции Ca + 2HCl " CaCl2 + H2# является
а)Ca. б)HCl. в)Ca2+. г)H2#. д)H+. е)Cl-.
16. Восстанавливается в реакции Fe + H2SO4 " FeSO4 + H2# является
а)Fe. б)H2SO4. в)Fe2+. г)H2#. д)H+. е)SO42-.
17. Восстановителем в реакции 2ZnS + 3O2 " 2ZnO + 2SO2 является
а)Zn2+. б)S2-. в)O20. г)S+4. д)O-2.
18. Окислителем в реакции 2ZnS + 3O2 " 2ZnO + 2SO2 является
а)Zn2+. б)S2-. в)O20. г)S+4. д)O-2.
19. Восстанавливается в реакции 4NH3 + 3O2 " 2N2 + 6H2O
а)NH3. б)O2. в)N2. г)H2O.
20. Окисляется в реакции 4NH3 + 3O2 " 2N2 + 6H2O
а)NH3. б)O2. в)N2. г)H2O.
21. Окислителем в реакции Zn + CuCl2 " ZnCl2 + Cu является
а)Zn0. б)Zn2+. в)Cu0. г)Cu2+. д)Cl-.
22. Восстановителем в реакции Zn + CuSO4 " ZnSO4 + Cu является
а)Zn0. б)Zn2+. в)Cu0. г)Cu2+. д)Cl-.
23. Процесс окисления в реакции Ca + S " CaS описывается уравнением
а)Ca0 - 2e- " Ca+2. б)Ca0 + 2e " Ca+2. в)Ca+2 + 2e " Ca0.
г)S0 - 2e " S+2. д)S0 + 2e " S-2.
24. Процесс восстановления в реакции Ca + S " CaS описывается уравнением
а)Ca0 - 2e- " Ca+2. б)Ca0 + 2e " Ca+2. в)Ca+2 + 2e " Ca0.
г)S0 - 2e " S+2. д)S0 + 2e " S-2.
25. Процесс окисления в реакции 3Zn + 2P " Zn3P2 описывается уравнением
а)P0 - 3e " P+3. б)P0 + 3e " P-3. в)P-3 - 3e " P0.
г)Zn0 - 2e- " Zn+2. д)Zn0 + 2e " Zn+2. е)Zn+2 + 2e " Zn0.
26. Процесс восстановления в реакции 3Zn + 2P " Zn3P2 описывается уравнением
а)P0 - 3e " P+3. б)P0 + 3e " P-3. в)P-3 - 3e " P0.
г)Zn0 - 2e- " Zn+2. д)Zn0 + 2e " Zn+2. е)Zn+2 + 2e " Zn0.
27. Окисление восстановителя в реакции Mg + H2SO4 (КОНЦ) " MgSO4 + S + H2O описывается уравнением
а)Mg0 - 2e " Mg+2. б)Mg0 + 2e " Mg-2. в)2H+ + 2e " H20.
г)S+6 + 6e- " S0. д)S+4 + 4e " S0. е)S0 - 6e " S+6.
28. Восстановление окислителя в реакции Mg + H2SO4 (КОНЦ) " MgSO4 + S + H2O описывается уравнением
а)Mg0 - 2e " Mg+2. б)Mg0 + 2e " Mg-2. в)2H+ + 2e " H20.
г)S+6 + 6e- " S0. д)S+4 + 4e " S0. е)S0 - 6e " S+6.
29. Процессу окисления в реакции I2 + Cl2 + H2O " HIO3 + HCl соответствует уравнение
а)I0 + e " I-. б)I0 + 5e " I-5. в)I0 - 5e " I+5.
г)Cl0 + e " Cl-. д)Cl0 - e " Cl+.
30. Процессу восстановления в реакции I2 + Cl2 + H2O " HIO3 + HCl соответствует уравнение
а)I0 + e " I-. б)I0 + 5e " I-5. в)I0 - 5e " I+5.
г)Cl0 + e " Cl-. д)Cl0 - e " Cl+.
31. Окислитель в реакции H2SO3 + Cl2 + H2O " H2SO4 + HCl участвует в процессе
а)H+ + e " H0. б)S+4 - 2e " S+6. в)S+6 + 2e " S+4.
г)Cl0 + e " Cl-. д)Cl0 - e " Cl+.
32. Восстановитель в реакции H2SO3 + Cl2 + H2O " H2SO4 + HCl участвует в процессе
а)H+ + e " H0. б)S+4 - 2e " S+6. в)S+6 + 2e " S+4.
г)Cl0 + e " Cl-. д)Cl0 - e " Cl+.
33. Коэффициент перед формулой восстановителя в уравнении H2S + O2 " SO2 + H2O
а)2. б)3. в)1. г)4.
34. Коэффициент перед формулой окислителя в уравнении H2S + O2 " SO2 + H2O
а)2. б)3. в)1. г)4.
35. Коэффициент перед формулой восстановителя в уравнении
H2SO3 + Cl2 + H2O " H2SO4 + HCl
а)2. б)3. в)1. г)4.
36. Коэффициент перед формулой окислителя в уравнении
H2SO3 + Cl2 + H2O " H2SO4 + HCl
а)2. б)3. в)1. г)4.
37. Коэффициент перед формулой восстановителя в уравнении
Mg + H2SO4 (КОНЦ) " MgSO4 + S + H2O
а)2. б)3. в)1. г)4.
38. Коэффициент перед формулой окислителя в уравнении
Mg + H2SO4 (КОНЦ) " MgSO4 + S + H2O
а)2. б)3. в)1. г)4.
39. Процесс восстановления в реакции CuO + NH3 " Cu + H2O + N2 происходит с участием
а)1-го электрона. б)2-х электронов. в)3-х электронов. г)4-х электронов.
40. Процесс восстановления в реакции CuO + NH3 " Cu + H2O + NO происходит с участием
а)1-го электрона. б)2-х электронов. в)3-х электронов. г)5-ти электронов.
41. Процесс окисления в реакции CuO + NH3 " Cu + H2O + NO происходит с участием
а)1-го электрона. б)2-х электронов. в)3-х электронов. г)5-ти электронов.
42. Процесс восстановления в реакции KNO3 + KI + H2SO4 " NO + I2 + K2SO4 + H2O происходит с участием
а)1-го электрона. б)2-х электронов. в)3-х электронов. г)5-ти электронов.
43. Коэффициент перед формулой окислителя в уравнении
P + HClO3 + H2O " H3PO4 + HCl
а)1. б)3. г)5. д)7.
44. Коэффициент перед формулой восстановителя в уравнении
P + HClO3 + H2O " H3PO4 + HCl
а)1. б)3. в)5. г)7.
45. Восстановительные свойства металлов усиливаются в ряду
а) 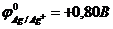 . б)
. б)  . в)
. в) 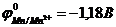 .
.
г)  . д)
. д) 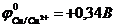 .
.
46. Окислительные свойства катионов металлов усиливаются в ряду
а) 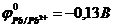 . б)
. б) 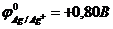 . в)
. в) 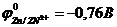 . г)
. г) 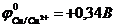 .
.
 2018-01-21
2018-01-21 614
614








