1. Величина электродного потенциала при стандартной температуре вычисляется по формуле
а) 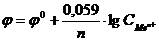 . б)
. б)  . в)
. в)  .
.
г)  . д)
. д) 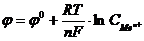 .
.
2. Величина электродного потенциала в условиях, которые отличаются от стандартных, вычисляется по формуле
а) 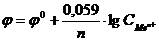 . б)
. б)  . в)
. в) 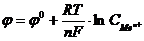 .
.
г)  . д)
. д)  .
.
3. Возникновение электродного потенциала на цинке показано на рисунке
а)  б)
б)  в)
в)  г)
г) 
4. Процесс установления равновесия на медном электроде отражает уравнение
а)Cu0 + 2e D Cu+2. б)Cu0 +2e D Cu-2.
в)Cu0 - 2e D Cu-2. г)Cu0 - 2e D Cu+2.
5. Электродвижущая сила гальванического элемента вычисляется по формуле:
а) 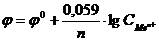 . б)
. б)  .
.
в)  . г)
. г) 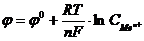 .
.
6. Величина электродвижущей силы гальванического элемента связана с изменением энергии Гиббса соотношением:
а) 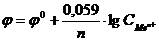 . б)
. б)  .
.
г)  . д)
. д) 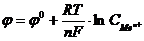 .
.
7. Элемент Даниеля - Якоби показан на схеме
| а) | -А) | Zn|Zn2+ || Cu2+ | Cu | (+K |
| б) | -А) | Zn|Zn2+ || Ag+ | Ag | (+K |
| в) | -А) | Zn|Zn2+ || Fe2+ | Fe | (+K |
| г) | -А) | Zn|Zn2+ || Cd2+ | Cd | (+K |
8. Измерению величины стандартного электродного потенциала цинка соответствует схема
| а) | -А) | Zn|Zn2+ || Cu2+ | Cu | (+K |
| б) | -А) | Co|Co2+|| Zn2+ | Zn | (+K |
| в) | -А) | Zn|Zn2+ || Ag+ | Ag | (+K |
| г) | -А) | Zn|Zn2+ || 2H+ | H2 (Pt) | (+K |
9. Правильно отображены границы раздела металл-раствор
| а) | -А) | Zn|Zn2+ || Cu2+ | Cu | (+K |
| б) | -А) | Zn,|Zn2+ || Ag+ | Ag | (+K |
| в) | -А) | Zn|Zn2+ || Fe2+, Fe | (+K |
| г) | -А) | Zn||Zn2+ || Cd2+ || Cd | (+K |
10. Границы, существующие между двумя электродами гальванического элемента, отображены правильно
| а) | -А) | Zn|Zn2+ | Cu2+ | Cu | (+K |
| б) | -А) | Co,Co2+,| Zn2+, Zn | (+K |
| в) | -А) | Zn|Zn2+ || Ag+ | Ag | (+K |
| г) | -А) | Zn|Zn2+,2H+ | H2 (Pt) | (+K |
11. Электродный потенциал возникает при погружении металла в раствор …
а) между атомами металла, находящимися на поверхности, и находящимися внутри компактного металла.
б) между атомами металла, находящимися внутри и раствором..
в) на поверхности металла.
г) в двойном электрическом слое, возникающем на границе между металлом и раствором.
12. Абсолютное значение электродного потенциала …
а) измерить нельзя ни при каких условиях.
б) измерить можно только при стандартных условиях.
в) измерить можно только в специальных условиях.
г) измерить нельзя только при стандартных условиях.
13. Электродным потенциалом называется потенциал, установившийся
а) на границе между поверхность металла и внутренним слоем металла.
б) между поверхностью металла и близлежащим слоем раствора в двойном электрическом слое.
в) на поверхности металла перед его погружением в раствор.
г) при соединении металла с другими металлами.
14. Стандартным электродным потенциалом называется …
а) потенциал, установившийся на границе металл-раствор при погружении металла в раствор собственной соли с концентрацией ионов металла 1 моль/л.
б) потенциал, установившийся на границе металл-раствор при погружении металла в раствор собственной соли, и измеренный с помощью вольтметра.
в) потенциал металла, погруженного в раствор собственной соли с концентрацией ионов металла 1 моль/л, и измеренный относительно стандартного водородного электрода при стандартных условиях.
г) потенциал, вычисленный по уравнению Нернста при стандартных условиях.
15. Потенциал стандартного водородного электрода.
а) имеет абсолютное значение 0 В.
б) имеет относительно значение 0 В.
в) условно принят равным 0 В.
г) отличается от 0 при стандартных условиях.
16. Стандартные электродные потенциалы измеряют по отношению к
а)потенциалу Земли. б)стандартному водородному электроду.
в)стандартному металлическому электроду.
г)эталону электродного потенциала.
17. Более активными, чем водород, являются металлы стандартный электродный потенциал  которых
которых
а) более положителен, чем у водорода.
б) более отрицателен, чем у водорода.
в) совпадает с потенциалом водорода.
г) больше, чем потенциал других металлов.
18.. Менее активными, чем водород, являются металлы
а) стандартный электродный потенциал которых более положителен, чем у водорода.
б) стандартный электродный потенциал которых более отрицателен, чем у водорода.
в) стандартный электродный потенциал которых совпадает с потенциалом водорода.
г) стандартный электродный потенциал которых больше, чем потенциал других металлов.
19. Металлы, стандартный электродный потенциал которых имеет отрицательную величину, ….
а) могут вытеснять водород из кислот.
б) не могут вытеснять водород из кислот.
в) могут вытеснять собственные катионы из растворов солей.
г) могут взаимодействовать с другими металлами.
20. Металлы, стандартный электродный потенциал которых имеет положительную величину, …
а) могут вытеснять водород из кислот.
б) не могут вытеснять водород из кислот.
в) могут вытеснять собственные катионы из растворов солей.
г) могут взаимодействовать с другими металлами.
21. Двойной электрический слой возникает между поверхностью
а) металла и внутренним слоем металла.
б) металла и близлежащим слоем раствора.
в) металла и поверхностью раствора.
г) раствора и глубинными слоями раствора.
22. Восстановительная активность металла ….
а) возрастает с уменьшением величины его стандартного электродного потенциала.
б) возрастает с увеличение величины его стандартного электродного потенциала.
в) убывает с уменьшением величины его стандартного электродного потенциала.
г) убывает с увеличением величины его стандартного электродного потенциала.
23. Уравнение Нернста позволяет вычислить..
а) абсолютное значение электродного потенциала.
б) значение стандартного электродного потенциала.
в) значение электродного потенциала при стандартных условиях.
г) значение электродного потенциала в условиях, отличающихся от стандартных.
24. Величина электродного потенциала зависит от …
а)природы металла. б)атмосферного давления.
в)концентрации ионов металла в растворе.
г)температуры. д)величины числа Фарадея.
25. Верно утверждение: Значение электродного потенциала …
а) можно вычислить по формуле Нернста.
б) можно измерить при стандартных условиях.
в) можно измерить в специальных условиях.
г) нельзя измерить ни при каких условиях.
26. Соответствие обозначений в уравнении Нернста 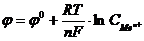 и их физический смысл
и их физический смысл
| а) | 
| 1) | потенциал электрода. | |
| б) | 
| 2) | стандартный водородный потенциал. | |
| в) | 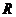
| 3) | стандартный электродный потенциал. | |
| г) | 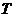
| 4) | универсальная газовая постоянная. | |
| д) | 
| 5) | температура в 0С. | |
| е) | 
| 6) | абсолютная температура. | |
| ж) | 
| 7) | число электронов, участвующих в равновесном процесс. | |
| 8) | постоянная Фарадея. | |||
| 9) | концентрация ионов металла, моль/л. |
27. Сера в соединении Na2SO3 имеет степень окисления:
а)0. б)2. в)4. г)6.
28. Наиболее сильными восстановительными свойствами обладает:
а)марганец (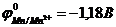 ). б)цинк (
). б)цинк ( ).
).
в)кадмий (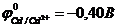 ). г)свинец (
). г)свинец (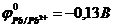 ).
).
29. Наиболее слабыми восстановительными свойствами обладает:
а)цинк (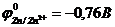 ). б)кадмий (
). б)кадмий (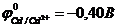 ).
).
в) 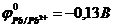 . г)
. г) 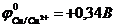 .
.
30. Будет вытеснять водород из кислот:
а)свинец (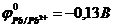 ). б)
). б)  .
.
в)висут ( ). г)медь (
). г)медь (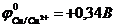 ).
).
31. Поясните обозначения на схеме стандартного водородного электрода и укажите условия измерений.

32. Наиболее слабыми восстановительными свойствами обладает:
а)марганец (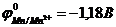 ). б)цинк (
). б)цинк ( ).
).
в)кадмий (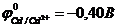 ). г)свинец (
). г)свинец (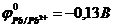 ).
).
33. Наиболее сильными восстановительными свойствами обладает:
а)цинк  ). б)кадмий (
). б)кадмий (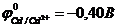 ).
).
в)свинец (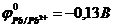 ). г)медь (
). г)медь (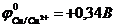 ).
).
34. Потенциал водородного электрода равен 0 В при концентрации ионов водорода
а)1 моль/л. б)2 моль/л. в)10 моль/л. г)0,1 моль/л.
35. Гальваническим элементом называется ….
а) устройство для пропускания электрического тока через раствор или расплав веществ.
б) устройство для превращения энергии окислительно-восстановительных реакций в электрическую энергию.
в) устройство для превращения энергии электрического тока в химическую энергию.
г) устройство для превращения энергии, выделяющейся при осуществлении реакции нейтрализации, в электрическую энергию.
36. Катодом в гальваническом элементе являются …
а) металл с более отрицательным потенциалом.
б) металл с более положительным потенциалом.
в) металл с большей атомной массой.
г) металл с меньшим радиусом атома.
37. Анодом в гальваническом элементе являются …
а) металл с более отрицательным потенциалом.
б) металл с более положительным потенциалом.
в) металл с большей атомной массой.
г) металл с меньшим радиусом атома.
38. На аноде гальванического элемента протекает …
а)процесс окисления. б)процесс восстановления.
в)процесс нейтрализации. г)процесс гибридизации.
38. На катоде гальванического элемента протекает …
а)процесс окисления. б)процесс восстановления.
в)процесс нейтрализации. г)процесс гибридизации.
39. При работе гальванического элемента анод …
а)заряжен положительно. б)заряжен отрицательно.
в)нейтрален. г)знак заряда изменяется при работе элемента.
40. При работе гальванического элемента катод …
а)заряжен положительно. б)заряжен отрицательно.
в)нейтрален. г)знак заряда изменяется при работе элемента.
41. Электродвижущая сила гальванического элемента равна
а) разности электродных потенциалов катода и анода.
б) разности электродных потенциалов анода и катода.
в) разности потенциалов приложенного тока.
г) разности потенциалов ионизации материала анода и материала катода.
42. Гальванический элемент является …
а)первичным источником тока. б)вторичным источником тока.
в)основным источником тока. г)третичным источником тока.
43. Аккумулятор является ….
а)первичным источником тока. б)вторичным источником тока.
в)основным источником тока. г)третичным источником тока.
44. В схеме гальванического элемента слева записывается …
а)анод. б)катод. в)электрод. г)ЭДС.
45. В схеме гальванического элемента справа записывается …
а)анод. б)катод. в)электрод. г)ЭДС.
46. В схеме гальванического элемента одна вертикальная черта символизирует (обозначает):
а) границу между двумя электродами.
б) границу между поверхностью электрода и раствором.
в) границу между электродом и потребителем энергии.
г) границу между катодом и анодом.
47. В кислотном аккумуляторе …
а) электроды - железные, кислота - серная.
б) электроды железные, кислота - соляная.
в) электроды - свинцовые, кислота - серная.
г) электроды свинцовые, кислота - соляная.
д) электроды оловянные, кислота - серная.
е) электроды оловянные, кислота - соляная.
48. На аноде в гальваническом элементе Даниеля - Якоби протекает реакция:
| а) | Zn0 – 2e " Zn2+ | б) | Cu2+ + 2e " Cu0 |
| в) | Zn0 + Cu2+ " Zn2+ + Cu0 | г) | Zn2+ + 2e " Zn0. |
49. Токообразующей в гальваническом элементе Даниеля - Якоби является реакция:
| а) | Zn0 – 2e " Zn2+ | б) | Cu2+ + 2e " Cu0 |
| в) | Zn0 + Cu2+ " Zn2+ + Cu0 | г) | Zn2+ + 2e " Zn0. |
50. Условием работы гальванического элемента является:
а)  . б)
. б)  . в)
. в)  . г)
. г) 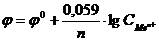 .
.
51. Железо будет растворяться при работе гальванического элемента, (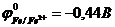 ,
, 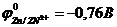 ,
, 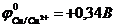 ,
, 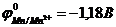 ,
, 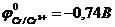 ).
).
а)железо - цинк б)железо - мель.
в)железо марганец. г)железо - хром.
52. В какой из приведенных пар металлов никель будет катодом при работе гальванического элемента, если известно, что 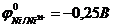 ,
, 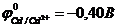 ,
, 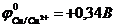 ,
, 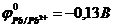 ,
, 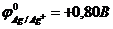 ?
?
а)никель - кадмий. б)никель - медью
в)никель - свинец. г)никель - серебро.
53. Железо НЕ будет растворяться при работе гальванического элемента (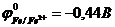 ,
, 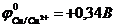 ,
, 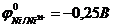 ,
, 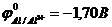 ,
, 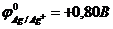 )
)
а)железо - медь. б)железо - никель.
в)железо - алюминий. г)железо - серебро.
54. Никель будет анодом в гальваническом элементе (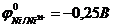 ,
, 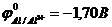 ,
, 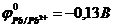 ,
, 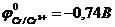 ,
, 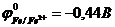 )
)
а)Ni | Ni2+ | |Al3+ | Al. б)Ni |Ni2+ || Pb2+ |Pb.
в)Ni |Ni2+ || Cr3+ | Cr. г)Ni| Ni2+ || Fe2+ | Fe.
55. Олово будет катодом в гальваническом элементе (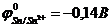 ,
, 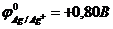 ,
, 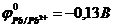 ?
? 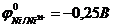 ,
,  )
)
а)Sn | Sn2+ | |Ag+ | Ag. б)Sn | Sn2+ || Pb2+ |Pb.
в)Sn | Sn2+|| Ni2+ | Ni. г)Sn | Sn2+ || Hg2+ | Hg.
56. Анодом в гальваническом элементе с железным катодом будут. (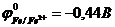 ,
, 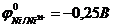 ,
, 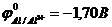 ,
,  ,
,  )
)
а)никель. б)алюминий. в)ртуть. г)цинк.
57. Гальванический элемент с участием олова в качестве одного из электродов не будет работать в прямом направлении (нельзя использовать для выработки электрической энергии), если стандартные электродные потенциалы металлов 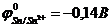 ,
, 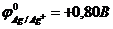 ,
, 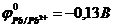 ?
? 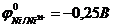 ,
,  ?Какой из приведенных
?Какой из приведенных
а)Sn | Sn2+ | |Ag+ | Ag. б)Sn | Sn2+ || Pb2+ |Pb.
в)Sn | Sn2+|| Ni2+ | Ni. г)Sn | Sn2+ || Hg2+ | Hg.
58. Гальванических элементов с участием никеля в качестве одного из электродов будет работать в прямом направлении (можно использовать для выработки электрической энергии), если стандартные электродные потенциалы металлов 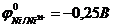 ,
, 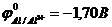 ,
, 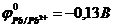 ,
, 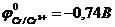 ,
, 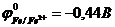 ?
?
а)Ni | Ni2+ | |Al3+ | Al. б)Ni |Ni2+ || Pb2+ |Pb.
в)Ni |Ni2+ || Cr3+ | Cr. г)Ni| Ni2+ || Fe2+ | Fe.
59. Правильно обозначены электроды, если известно, что 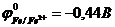 ,
, 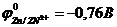 ,
, 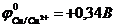 ,
, 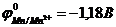 ,
, 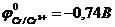 в гальваническом элементе
в гальваническом элементе
а)-A) Fe | Fe2+ || Zn2+ | Zn (K+. б)-A) Fe | Fe2+ || Cu2+ | Cu (K+.
в)-A) Fe | Fe2+ || Mn2+ | Mn (K+. г)-A) Fe | Fe2+ || Cr3+ | Cr (K+.
60. Токообразующая реакция Zn0 + Cu2+ " Zn2+ + Cu0 осуществляется в гальваническом элементе (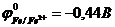 ,
, 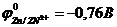 ,
, 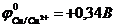 )
)
а)-A) Zn | Zn2+ || Fe2+ | Fe (K+. б)-A) Zn | Zn2+|| Cu2+ | Cu (K+.
в)-A) Cu2+ | Cu || Zn | Zn2+ (K+. г)-A) Zn | Zn2+|| Cu0 | Cu2+ (K+.
61. На катоде гальванического элемента Ni |Ni2+ || Pb2+ |Pb, (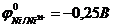 ,
, 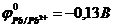 ) происходит процесс:
) происходит процесс:
а)Ni0 - 2e " Ni2+. б)Ni2+ + 2e " Ni0.
в)Pb0 - 2e " Pb2+. г)Pb2+ + 2e " Pb0.
62. На аноде работающего гальванического элемента Sn | Sn2+ | |Ag+ | Ag (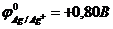 ,
, 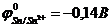 ) происходит процесс
) происходит процесс
а)Sn0 - 2e " Sn2+. б)Sn2+ +2e " Sn0. в)Sn0 + 2e " Sn2+.
г)Ag+ + e " Ag0. д)Ag0 - e " Ag+. е)Ag0 + e " Ag+.
61. Процесс Ni2+ + 2e " Ni0? (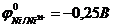 ,
, 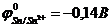 ,
, 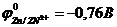 ,
, 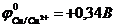 ) будет происходить в гальваническом элементе
) будет происходить в гальваническом элементе
а)Ni | 2H+ || Cu2+ | Cu0. б)Ni | Ni2+ || Zn2+ | Zn0.
в)Ni | Ni2+ || Cu2+ | Cu0. г)Ni | Ni2+ || Sn2+ | Sn0.
62. На аноде будет происходить процесс Ni0 - 2e " Ni2+? (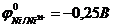 ,
, 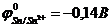 ,
, 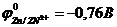 ,
, 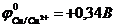 ) в гальваническом элементе
) в гальваническом элементе
а)Ni | 2H+ || Cu2+ | Cu0. б)Ni | Ni2+ || Zn2+ | Zn0.
в)Ni | Ni2+ || Cu2+ | Cu0. г)Ni | Ni2+ || Sn2+ | Sn0.
63. Железо окисляется в гальваническом элементе
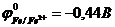 ,
, 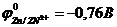 ,
, 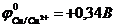 ,
, 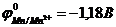 ,
, 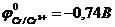 ?
?
а)Fe | Fe2+ || Zn2+ | Zn. б)Fe | Fe2+ || Cu2+ | Cu.
в)Fe | Fe2+ || Mn2+ | Mn. г)Fe | Fe2+ || Cr3+ | Cr.
64. Наибольшая электродвижущая сила у гальванического элемента
(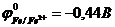 ,
, 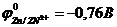 ,
, 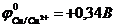 ,
, 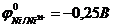 ,
, 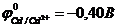 )
)
а)Fe | Fe2+ || Cu2+ | Cu. б)Ni | Ni2+ || Cu2+ | Cu0.
в)Zn | Zn2+|| Cu2+ | Cu. г)Cd | Cd2+|| Cu2+ | Cu.
65. Электродвижущая сила гальванического элемента, составленного из цинка и ртути (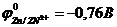 ,
,  )?
)?
а)-0,09 В. б)0,09 В. в)1,52 В. г)1,61 В.
1,7 В.
66. Электродвижущая сила гальванического элемента, составленного из цинка и марганца, (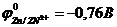 ,
, 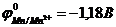 ) равна
) равна
а)-0,42 В. б)0,42 В. в)1,94 В. г)- 1,94В.
67. ЭДС гальванического элемента, составленного из марганцевого (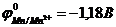 ) и серебряного (
) и серебряного (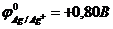 ) электродов, при концентрации ионов металла, являющегося катодом, 0,001 моль/л и ионов металла, являющегося анодом, 0,1 моль/л равна _____.
) электродов, при концентрации ионов металла, являющегося катодом, 0,001 моль/л и ионов металла, являющегося анодом, 0,1 моль/л равна _____.
68. Наибольшая электродвижущая сила у гальванического элемента
(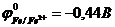 ,
, 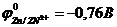 ,
, 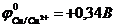 ,
, 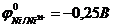 ,
, 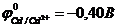 )
)
а)Fe | Fe2+ || Cu2+ | Cu. б)Ni | Ni2+ || Cu2+ | Cu0.
в)Zn | Zn2+|| Cu2+ | Cu. г)Cd | Cd2+|| Cu2+ | Cu.
69. ЭДС гальванического элемента, составленного из цинкового (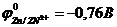 ) и оловянного (
) и оловянного (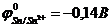 ) электродов, при концентрации ионов металла, являющегося катодом, 0,001 моль/л и ионов металла, являющегося анодом, 0,01 моль/л равна _____.
) электродов, при концентрации ионов металла, являющегося катодом, 0,001 моль/л и ионов металла, являющегося анодом, 0,01 моль/л равна _____.
 2018-01-21
2018-01-21 977
977








