1-й уровень
1. Электролиты - это вещества, растворы которых
| а)не проводят электрический ток. | б)проводят электрический ток. |
| в)не проводят тепло. | г)проводят тепло. |
| д)подкисляют раствор. |
2. Неэлектролиты - это вещества, растворы которых
| а)не проводят электрический ток. | б)проводят электрический ток. |
| в)не проводят тепло. | г)проводят тепло. |
| д)подкисляют раствор. |
3. Электролиты – это…
| а)металлы. | б)неметаллы. | в)оксиды металлов. |
| г)основания. | д)оксиды неметаллов. | е)кислоты. |
| ж)соли. | з)все органические вещества. |
4. Уравнение процесса электролитической диссоциации:
| а)АВ D А+ + В-. | б)АВ D А0 + В0. | в)А+ + В- D АВ. | г)А+ + В- " АВ. |
5. Значение ионного произведения воды:
| а)7. | б)14. | в)18. | г)1,8×10-16. | д)10-14. |
6. рН раствора вычисляется по формуле:
а) 
| б) 
| в) 
| г) 
|
7. Электролиты классифицируют на сильные и слабые по величине
а) 
| б) 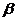
| в) 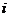
| г) 
| д) 
|
8. рН щелочного раствора:
| а)рН < 7. | б)рН = 7. | в)рН > 7. | г)не имеет рН. |
2-й уровень
1. Степенью электролитической диссоциации называется
а) электрическая проводимость раствора.
б) отношение числа распавшихся на ионы молекул к общему числу всех молекул в растворе.
в) отношение числа распавшихся на ионы молекул к числу молекул электролита в растворе.
г) отношение числа ионов к изотоническому коэффициенту.
2. Величина степени электролитической диссоциации зависит от
| а)температуры. | б)концентрации раствора. |
| в)природы растворителя. | г)объема сосуда. |
| д)цвета вещества. | е)природы вещества. |
3. Законы теории растворов для электролитов и неэлектролитов различны, потому что электролиты
| а)изменяют электропроводность раствора | б)связывают большее число молекул воды и уменьшают общее число частиц в растворе. |
| в)изменяют структуру воды. | г)распадаются на ионы и увеличивают число частиц в растворе. |
4. Гидролизу подвергаются соли, образованные …
| а)слабым катионом и слабым анионом. | б)слабым катионом и сильным анионом. |
| в)сильным катионом и сильным анионом. | г)сильным катионом и слабым анионом. |
| д)двухзарядным катионом и однозарядным анионом. |
5. Степень гидролиза усиливается при ….
| а)повышении температуры. | б)добавлении воды. | в)перемешивании раствора соли. | г)добавлении индикаторов. |
6. Слабые электролиты имеют величину степени диссоциации…
| а)3% £ a. | б)0,03 £ a £ 0,3. | в)a £ 3%. | г)a £ 0,3. |
7. Электролиты, при диссоциации которых образуются катионы водорода и кислотные остатки, называются …
| а)кислотными оксидами. | б)основаниями. | в)основными оксидами. |
| г)кислотами. | д)солями. |
8. Электролиты, при диссоциации которых образуются анионы OH- и катионы металла, называются …
| а)кислотными оксидами. | б)основаниями. |
| в)основными оксидами. | г)солями. |
9. Электролиты, при диссоциации которых образуются катионы металла и анионы кислотного остатка, называются …
| а)кислотными оксидами. | б)солями. |
| в)основаниями. | г)основными оксидами. |
| д)кислотами. |
10. Закон разбавления Оствальда имеет вид  , где С - концентрация…
, где С - концентрация…
| а)молекул, не распавшихся на ионы | б)положительных ионов |
| в)растворенного вещества | г)отрицательных ионов |
11. Ионным произведением воды (КВ) называется …
а) величина константы диссоциации воды.
б) электропроводность чистой воды при стандартной температуре.
в) произведение константы диссоциации воды на ее молярную концентрацию.
г) логарифм величины константы диссоциации.
3-й уровень
1. Соответствие между степенью диссоциации веществ и силой электролита:
| а) | Na2SO4 ( = 90%) = 90%)
| 1) | сильный | |
| б) | H2SO3 ( = 25%) = 25%)
| 2) | средний | |
| в) | CH3COOH ( = 2, 5%) = 2, 5%)
| 3) | слабый | |
| г) | C12H22O11 ( = 0%) = 0%)
| 4) | неэлектролит | |
| 5) | высококипящее соединение |
2. Сильные электролиты - это
а)NaOH ( = 90%). = 90%).
| б)Na2SO4 ( = 90%). = 90%).
| в)HCN ( = 0,2%). = 0,2%).
|
г)KNO3 ( = 90%). = 90%).
| д)H3PO4 ( = 28%). = 28%).
| е)H2S ( = 0,01%) = 0,01%)
|
3. Слабые электролиты - это
а)NaOH ( = 90%). = 90%).
| б)Na2SO4 ( = 90%). = 90%).
| в)HCN ( = 0,2%). = 0,2%).
|
г)KNO3 ( = 90%). = 90%).
| д)H3PO4 ( = 28%). = 28%).
| е)H2S ( = 0,01%) = 0,01%)
|
4. Уравнение для вычисления произведения растворимости сульфида серебра Ag2S:
а)  или или  . .
| б)  или или  . .
|
в)  или или  . .
| г)  или или  . .
|
5. Соответствие между формулами электролитов и классом вещества:
| а) | NaCl. | 1) | металл. | |
| б) | Ba(OH)2. | 2) | кислота. | |
| в) | H4P2O7. | 3) | соль. | |
| г) | Ca(NO3)2. | 4) | кислотный оксид. | |
| 5) | основание. |
6. Выражение константы диссоциации 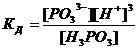 соответствует уравнению:
соответствует уравнению:
| а)H3PO3 D H+ + H2PO3- | б)H2PO3- D H+ + HPO32-. |
| в)HPO32- D H+ + PO33-. | г)H3PO3 D 3H++ PO33-. |
7. Среда, образуемая водным раствором Na2CO3 :
| а)кислая. | б)нейтральная. | в)щелочная. | г)индикаторная. |
8. Соответствие между обозначением и его физическим смыслом в формуле  .
.
| а) | 
| 1) | температура кипения раствора. | |
| б) | 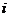
| 2) | повышение температуры кипения раствора. | |
| в) | 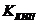
| 3) | понижение температуры кипения раствора. | |
| г) | 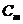
| 4) | изотонический коэффициент. | |
| 5) | степень диссоциации. | |||
| 6) | эбулиоскопическая постоянная. | |||
| 7) | моляльная концентрация вещества. | |||
9. Выражение 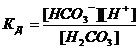 соответствует уравнению
соответствует уравнению
| а)H2CO3 D H+ + HCO3- | б)HCO3- D H+ + CO32- |
| в)H2CO3 D 2H++ CO32- | г)H2CO3 D H+2+ CO32- |
10. Среда, образуемая водным раствором К2CO3:
| а)кислая. | б)нейтральная. | в)щелочная. | г)индикаторная. |
11. Среда, образуемая водным раствором Na2SO4:
| а)кислая. | б)нейтральная. | в)щелочная. |
| г)индикаторная. | д)естественная. |
Уровень
1. Изотонический коэффициент раствора NaNO3 равен 1,8. Величина степени диссоциации α при этом …..
а)18%. б)1,8. в)0,8. г)2.
2. Степень диссоциации H2SO3 составила 25%. Тогда величина изотонического коэффициента i равна
а)0,25. б)1,5. в)3,0. г)1,25.
3. Изотонический коэффициент раствора CH3COOH равен 1,04. Тогда величина степени диссоциации α …..
а)1,04 б)1,00. в)0,04. г)2,04.
4. Уравнение первой стадии гидролиза Na2CO3
| а)Na+ + H2O D NaOH + H+. | б)CO3- + H2O D HCO3 + OH-. |
| в)CO32- + H2O D HCO3- + OH-. | г)HCO3- + H2O D H2CO3 + OH-. |
5. Концентрация ионов H+ в растворе с рН =1 составляет …. моль/л
6. ПР хлорида серебра AgCl равно ……, если его растворимость составляет 1,07×10-5 моль/л
а)1,07×10-5. б)2,14×10-5. в)1,14×10-10. г)1,14×10-5.
7. рН раствора с концентрацией ионов водорода 1 моль/л равен….
 2018-01-21
2018-01-21 657
657








