Самопроизвольно, т. с. без затраты работы извне, система может переходить только из менее устойчивого состояния в более устойчивое. В химических процессах одновременно действуют две тенденции: стремление частиц объединяться за счет прочных связей в более сложные, что уменьшает энтальпию системы, и стремление частиц разъединиться, что увеличивает энтропию. Иными словами, проявляется действие двух прямо противоположных факторов — энтальпийного ( ) и энтропийного (
) и энтропийного (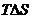 ). Суммарный эффект этих двух противоположных тенденций в процессах, протекающих при постоянных Т и р, отражает изменение энергии Гиббса G (или изобарно-изотермического потенциала):-
). Суммарный эффект этих двух противоположных тенденций в процессах, протекающих при постоянных Т и р, отражает изменение энергии Гиббса G (или изобарно-изотермического потенциала):-

Характер изменения энергии Гиббса позволяет судить о принципиальной возможности или невозможности осуществления процесса. Условием принципиальной возможности процесса является неравенство

Иными словами, самопроизвольно протекают реакции, если энергия Гиббса в исходном состоянии системы больше, чем в конечном. Увеличение энергии Гиббса

свидетельствует о невозможности самопроизвольного осуществления процесса в данных условиях. Если же

система находится в состоянии химического равновесия.
При обратимом и изотермическом проведении процесса  равно по абсолютной величине, но обратно по знаку максимальной полезной работе, которую система производит в данном процессе
равно по абсолютной величине, но обратно по знаку максимальной полезной работе, которую система производит в данном процессе

Полезной работой называется вся производимая в ходе процесса работа за вычетом работы расширения 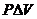 .
.
Величина изменения энергии Гиббса при реакции зависит от температуры, а также от природы и концентраций взятых и получающихся веществ.
 2018-01-21
2018-01-21 2737
2737
