Каждая окислительно-восстановительная реакция слагается из полуреакций окисления и восстановления. Когда реакция протекает в гальваническом элементе или осуществляется путем электролиза, то каждая полуреакция протекает на соответствующем электроде; поэтому полуреакции называют также электродными процессами.
Протекающей в гальваническом элементе окислительно-восстановительной реакции соответствует э. д. с. этого элемента Е, связанная с изменением энергии Гиббса  реакции уравнением:
реакции уравнением:

В соответствии с разделением окислительно-восстановительной реакции на две полуреакции, электродвижущие силы также принято представлять в виде разности двух величин, каждая из которых отвечает данной полуреакции. Эти величины называются электродными потенциалами.
Для медно-цинкового элемента реакция, протекающая при его работе

разбивается на полуреакции:

Соответственно, э. д. с. этого элемента (Е) можно представить как разность электродных потенциалов (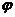 ), один из которых (
), один из которых ( ) отвечает первой, а другой (
) отвечает первой, а другой ( )—второй из записанных полуреакций:
)—второй из записанных полуреакций:

При этом изменение энергии Гиббса  которое отвечает термодинамически обратимому восстановлению одного моля ионов меди, равно
которое отвечает термодинамически обратимому восстановлению одного моля ионов меди, равно

а изменение энергии Гиббса 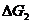 , отвечающее термодинамически обратимому окислению одного моля атомов цинка, равно
, отвечающее термодинамически обратимому окислению одного моля атомов цинка, равно

В общем случае, любому электродному процессу

соответствует электродный потенциал 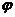 и изменение энергии Гиббса
и изменение энергии Гиббса  , равное:
, равное:

В результате изучения потенциалов различных электродных процессов установлено, что их величины зависят от следующих трех факторов: 1) от природы веществ—участников электродного процесса, 2) от соотношения между концентрациями этих веществ и 3) от температуры системы. Эта зависимость выражается уравнением:

Здесь  — стандартный электродный потенциал данного процесса; R— газовая постоянная; Т — абсолютная температура; г— число электронов, принимающих участие в процессе; F— число Фарадея; [Ох] и [Red]—произведения концентраций веществ, участвующих в процессе в окисленной (Ох) и в восстановленной (Red) формах.
— стандартный электродный потенциал данного процесса; R— газовая постоянная; Т — абсолютная температура; г— число электронов, принимающих участие в процессе; F— число Фарадея; [Ох] и [Red]—произведения концентраций веществ, участвующих в процессе в окисленной (Ох) и в восстановленной (Red) формах.
Физический смысл величины  становится ясным при рассмотрении случая, когда концентрации (активности) всех веществ, участвующих в данном электродном процессе, равны единице. При этом условии второе слагаемое правой части уравнения обращается, в нуль (lg1=0) и уравнение принимает вид:
становится ясным при рассмотрении случая, когда концентрации (активности) всех веществ, участвующих в данном электродном процессе, равны единице. При этом условии второе слагаемое правой части уравнения обращается, в нуль (lg1=0) и уравнение принимает вид:

Концентрации (активности), равные единице, называются стандартными концентрациями (активностями). Поэтому и потенциал, отвечающий этому случаю, называется стандартным потенциалом. Итак, стандартный электродный потенциал—это потенциал данного электродного процесса при концентрациях (точнее говоря, активностях) всех участвующих в нем веществ, равных единице.
Для обычной при электрохимических измерениях стандартной температуры (25 °С == 298 К), при подстановке значений постоянных величин (R = 8,31 Дж/(моль-К), F= 96500 Кл/моль] уравнение принимает вид:

Для построения численной шкалы электродных потенциалов нужно потенциал какого-либо электродного процесса принять равным нулю. В качестве эталона для создания такой шкалы принят электродный процесс

Изменение энергии Гиббса, связанное с протеканием этой полуреакции при стандартных условиях, принимается равным нулю. В соответствии с этим и стандартный потенциал данного электродного процесса принят равным нулю. Все электродные потенциалы, приводимые в справочных данных выражены по этой, так называемой водородной шкале. Этот электродный процесс осуществляется на водородном электроде, который представляет собой платиновую пластинку, электролитически покрытую губчатой платиной и погруженную в раствор кислоты, через который пропускается водород (см рис.).

Водород хорошо растворяется в платине; при этом молекулы водорода частично распадаются на атомы (платина катализирует этот распад). На поверхности соприкосновения платины с раствором кислоты может протекать окисление атомов или восстановление ионов водорода. Платина при этом практически не принимает участия в электродных реакциях и играет как бы роль, губки, пропитанной атомарным водородом.
Потенциал водородного электрода воспроизводится с очень высокой точностью. Поэтому водородный электрод и принят в качестве эталона при создании шкалы электродных потенциалов.
Установим, какой вид принимает общее уравнение электродного потенциала для водородного электрода, В соответствии с уравнением электродного процесса z = 2, [Ox] = [H+]2, [Red] = [H2]. Концентрация растворенного в платине водорода пропорциональна его, парциальному давлению 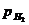 :
:

где  — постоянная при данной температуре величина. Включаяеев значение
— постоянная при данной температуре величина. Включаяеев значение  , получим:
, получим:

Обычно парциальное давление водорода 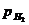 поддерживается равным нормальному атмосферному давлению, которое условно принимается за единицу. В этом случае последний член полученного уравнения обращается в нуль (lgI = 0). Тогда:
поддерживается равным нормальному атмосферному давлению, которое условно принимается за единицу. В этом случае последний член полученного уравнения обращается в нуль (lgI = 0). Тогда:
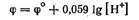
Поскольку стандартный потенциал рассматриваемого процесса-принят равным нулю, то

или, учитывая, что lg[H+]= — рН, окончательно получаем:

Для определения потенциала того или иного электродного процесса нужно составить гальванический элемент из испытуемого и стандартного водородного электродов и измерить его э. д. с. Поскольку потенциал стандартного водородного электрода равен нулю, то измеренная э. д. с. будет представлять собою потенциал данного электродного процесса
 2018-01-21
2018-01-21 646
646








