При любой окислительно-восстановительной реакции происходит переход электронов от восстановителя к окислителю. Так, при опускании цинковой пластинки в раствор сульфата меди происходит реакция
Zn + Cu2+ = Си + Zn2+
Здесь восстановитель — цинк — отдает электроны. Эта полуреакция выражается уравнением:
Zn = Zn2+ 2е -
Окислитель — ион меди — принимает электроны. Уравнение этой полуреакции имеет вид:
Си2+ + 2е- = Си
Эту реакцию можно осуществить таким способом, что окислительная и восстановительная полуреакции окажутся пространственно разделенными, а электроны будут переходить от восстановителя к окислителю не непосредственно, а по проводнику электрического тока — по внешней цепи. Этот направленный поток электронов представляет собою электрический ток. При таком осуществлении окислительно-восстановительной реакции ее энергия будет превращена в электрическую энергию, которую можно использовать, включив во внешнюю цепь устройство, потребляющее электрическую энергию (например, электронагревательный прибор, электрическую лампу и т. п.).
Гальванические элементы – это устройства, которые применяют для непосредственного преобразования энергии химической реакции в электрическую энергию.
В качестве примера на рисунке приведен медно-цинковый гальванический элемент, работающий за счет энергии приведенной выше реакции между цинком и сульфатом меди.
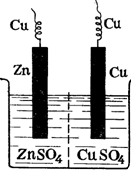
При работе элемента, т. е. при замкнутой цепи, цинк окисляется: на поверхности его соприкосновения с раствором атомы цинка превращаются в ионы и, гидратируясь, переходят в раствор. Высвобождающиеся при этом электроны движутся по внешней цепи к медному электроду. На медном электроде протекает восстановление ионов меди. Электроны, приходящие сюда от цинкового электрода, соединяются с выходящими из раствора дегидратирующимися ионами меди; образуются атомы меди, выделяющиеся в виде металла.
Таким образом, при работе гальванического элемента электроны от восстановителя переходят к окислителю по внешней цепи, на электродах идут электрохимические процессы, в растворе наблюдается направленное движение ионов.
Электрод, на котором протекает окисление, называется анодом. Электрод, на котором протекает восстановление, называется катодом. В медно-цинковом элементе цинковый электрод является анодом, а медный — катодом.
Протекающая в гальваническом элементе окислительно-восстановительная реакция представляет собой сложный процесс. Она включает собственно электрохимические стадии (превращения атомов, ионов или молекул на электродах), перенос электронов, перенос ионов. Все эти стадии сопряжены между собой и протекают с одной и той же скоростью; число электронов, которые за единицу времени отдает цинк, равно числу электронов, принимаемых за это же время ионами меди. Поэтому скорость реакции, протекающей в гальваническом элементе, пропорциональна количеству электричества, перенесенного по цепи в единицу времени, т. е. силе тока в цепи.
Электрический ток, протекающий по внешней цепи гальванического элемента, может производить полезную работу. Но работа, которую можно выполнить за счет энергии химической реакции, зависит от ее скорости: она максимальна при бесконечно медленном—обратимом—проведении реакции. Следовательно, работа, которую можно произвести за счет реакции, протекающей в гальваническом элементе, зависит от величины отбираемого от него тока. Если, увеличивая сопротивление внешней цепи, уменьшать ток до бесконечно малого значения, то и скорость реакции в элементе тоже будет бесконечно малой, а работа — максимальной. Теплота, выделяемая во внутренней цепи элемента, будет при этом, наоборот, минимальна.
Работа электрического тока выражается произведением количества прошедшего по цепи электричества на напряжение. В медно-цинковом элементе при окислении одного эквивалента цинка и одновременном восстановлении одного эквивалента ионов меди по цепи пройдет один фарадей (F = 96485 кулонов) электричества, так что полезная работа А', которую ток может совершить, будет равна
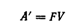
где V— напряжение между полюсами элемента.
Но поскольку эта работа зависит от силы тока, то и напряжение между полюсами элемента тоже зависит от силы тока (F — величина постоянная). В предельном случае, отвечающем обратимому протеканию реакции, напряжение будет максимальным.
ЭДС гальванического элемента – это максимальное значение напряжения гальванического элемента, соответствующее обратимому протеканию реакции.
Для этого предельного случая полезная работа, производимая электрическим током в медно-цинковом элементе при взаимодействии одного эквивалента цинка с одним эквивалентом ионов меди, выразится уравнением
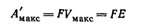
где 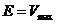 — э. д. с. элемента.
— э. д. с. элемента.
При взаимодействии одного моля атомов цинка с одним молем ионов меди уравнение примет вид:
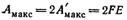
В общем случае при растворении (или выделении) одного моля вещества, ионы которого имеют заряд равный z, максимальная полезная работа связана с э. д. с. уравнением:

При постоянных температуре и давлении максимальная полезная работа реакции равна взятому с обратным знаком изменению энергии Гиббса  . Отсюда:
. Отсюда:

Если концентрации веществ, участвующих в реакции, равны единице, т. е. если соблюдаются стандартные условия, то э.д.с. элемента называется его стандартной электродвижущей силой и обозначается Е°. При этом последнее уравнение принимает вид:

 2018-01-21
2018-01-21 1168
1168
