В термодинамике для сравнительной оценки работоспособности изолированной системы в нескольких состояниях используется функция, называемая энтропией.
Большинство процессов представляет собой два одновременно происходящих явления: передачу энергии и изменение в упорядоченности расположения частиц относительно друг друга. Частицам (молекулам, атомам, ионам) присуще стремление к беспорядочному движению, поэтому система стремится перейти из более упорядоченного состояния в менее упорядоченное. Так, если, например, баллон с газом соединить с сосудом, то газ из баллона будет распределяться по всему объему сосуда. При этом система из более упорядоченного состояния (с меньшим беспорядком) переходит в состояние менее упорядоченное (с большим беспорядком). Количественной мерой беспорядка является и является энтропия S. При переходе системы из более упорядоченного в менее упорядоченное состояние энтропия возрастает ( >0)..Переход же системы из менее упорядоченного состояния в более упорядоченное связан с уменьшением энтропии, и самопроизвольное протекание подобного процесса менее вероятно. Так, ясно, что в рассматриваемом примере невероятно, чтобы газ сам собой собрался в баллоне. В случае перехода системы из менее упорядоченного состояния в более упорядоченное энтропия системы уменьшается (
>0)..Переход же системы из менее упорядоченного состояния в более упорядоченное связан с уменьшением энтропии, и самопроизвольное протекание подобного процесса менее вероятно. Так, ясно, что в рассматриваемом примере невероятно, чтобы газ сам собой собрался в баллоне. В случае перехода системы из менее упорядоченного состояния в более упорядоченное энтропия системы уменьшается ( <0).
<0).
Энтропия возрастает при переходе жидкости в пар, при растворении кристаллического вещества и т.д.
Для ряда процессов теплота связана с изменением энтропии следующими соотношениями:

 (при максимальной работе и постоянной температуре)
(при максимальной работе и постоянной температуре)
В приведенных выше уравнениях 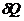 - бесконечно малая теплота, a dS -бесконечно малое изменение энтропии. Если температура Т остается постоянной, то в ряде случаев удобнее пользоваться последним соотношением.
- бесконечно малая теплота, a dS -бесконечно малое изменение энтропии. Если температура Т остается постоянной, то в ряде случаев удобнее пользоваться последним соотношением.
Если в системе, кроме работы расширения 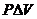 , совершаются другие виды работы W', то выражение для баланса энергии записывается в следующей форме:
, совершаются другие виды работы W', то выражение для баланса энергии записывается в следующей форме:

Для качественной оценки способности системы совершать работу при постоянном объеме и при постоянной температуре в уравнение баланса энергии  внесем изменения:
внесем изменения:

Работа расширения 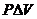 исчезла, так как объем системы остается постоянным а вместо теплоты при постоянной температуре и максимальной величине других типов работы записано произведение
исчезла, так как объем системы остается постоянным а вместо теплоты при постоянной температуре и максимальной величине других типов работы записано произведение 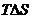 .
.
Новое уравнение можно переписать следующим образом:
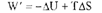
Если работа  при постоянных V и Т положительна, то это означает, что eе может совершать сама система и все самопроизвольные изменения в ней идут в этом направлении, если же она отрицательна, то процесс не может самопроизвольно идти в данном направлении.
при постоянных V и Т положительна, то это означает, что eе может совершать сама система и все самопроизвольные изменения в ней идут в этом направлении, если же она отрицательна, то процесс не может самопроизвольно идти в данном направлении.
 2018-01-21
2018-01-21 1260
1260
