
Молярная концентрация.
Представляет собой отношение количества растворенного вещества (в молях) к объему раствора (в литрах).

Представляет собой отношение количества эквивалентов растворенного вещества (в молях) к объему раствора (в литрах).
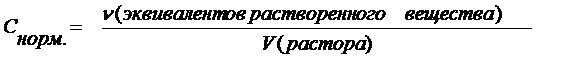

Моляльность.
Моляльность раствора характеризуется количеством растворенного вещества в молях, приходящихся на 1кг растворителя в данном растворе.

Размерность моляльности [моль/кг растворителя].
закон эквивалентов для растворов:
произведение нормальной концентрации одного раствора на его объем равно произведению нормальной концентрации другого раствора на его объем, или
 ∙ V1 =
∙ V1 = 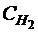 ∙ V2
∙ V2
М f
С масс ó См ó Сн
Нормальная концентрация больше или равна молярной концентрации(на f эквивалентности).
Вопрос №16 Растворы неэлектролитов. Давление насыщенного пара растворителя над раствором и над чистым растворителем. Закон Рауля. Как можно рассчитать повышение температуры кипения и понижение температуры замерзания раствора по сравнению с растворителем?
Неэлектролитами называются вещества, растворы или расплавы которых электрический ток не проводят.
Это вещества с ковалентными неполярными или малополярными связями.
Например:
некоторые газы (азот, кислород),
некоторые твердые вещества (сера, кремний, медь),
некоторые органические соединения (сахароза, бензол, этиловый спирт).
 2018-01-21
2018-01-21 370
370








