Экспериментальные методы определения скорости и константы скорости реакций
№7
Зависимость скорости реакции от температуры
Правило Вант-Гоффа: при увеличении t реакционной смеси на 10 градусов, скорость реакции увеличивается в 2-4 раза.
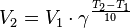
где  — скорость реакции при температуре
— скорость реакции при температуре  ,
,  — скорость реакции при температуре
— скорость реакции при температуре  ,
,  — температурный коэффициент реакции
— температурный коэффициент реакции
Правилу Вант-Гоффа не подчиняются реакции, в кот. принимают участие громоздкие молекулы (белки в биологических системах)
Более точно зависимость скорости от температуры показывает уравнение Аррениуса:

Здесь k – константа скорости реакции, А- предэкспоненциальный коэффициент, зависит от температуры,  — универсальная газовая постоянная, Ea – барьер, энергия, которую надо сообщить 1 моль вещества, чтобы молекулы в нем стали активны, ex – экспонент
— универсальная газовая постоянная, Ea – барьер, энергия, которую надо сообщить 1 моль вещества, чтобы молекулы в нем стали активны, ex – экспонент
Ea=0 для ионный реакций в растворе.
Чем больше Ea, тем меньше скорость реакции, чем больше Т, тем больше скорость.
ТЕМПЕРАТУРНЫЙ КОЭФФИЦИЕНТ (Q10), величина, равная отношению скорости биохимической реакции при повышенной на 10°С температуре воздуха к первоначальному значению скорости.
С повышением температуры скорость биохимических процессов в определенном интервале температур возрастает. Температурный коэффициент реакции ((Q10) для ферментативных процессов равен 1-2 (исключение составляют два типа реакций: термическая инактивация ферментов и денатурация белков в температурной зоне денатурации, для которых значение Q10 колеблется от десятков до нескольких сотен). Для каждого фермента имеется свой температурный оптимум, при котором скорость процесса оказывается максимальной; для ферментов животного происхождения он обычно лежит в зоне температур 40-50° и для растительных ферментов при 50-60°.
Теория активных соударений была сформулирована С. Аррениусом в 1889 году. Основные положения теории:
1) для протекания химической реакции необходимо соударение между молекулами исходных веществ;
2) не каждое соударение молекул приводит к химическому превращению; к нему приводит лишь активное соударение, то есть
соударения, между молекулами, обладающими большим запасом энергии. Минимальный запас энергии, которым должны обладать молекулы исходных веществ, чтобы соударения между ними были активными, называется энергетическим барьером реакции (например, азот и кислород воздуха не могут преодолеть энергетический барьер). Каждая реакция характеризуется своим энергетическим барьером
 2018-01-21
2018-01-21 765
765







