Электролиты - это вещества, растворы и расплавы которых проводят электрический ток (кислоты, соли, щёлочи). Эти растворы сильно отклоняются от всех рассмотренных законов. Для них осмотическое давление, понижение давления пара, изменения температур кипения и замерзания всегда больше, чем это отвечает концентрации раствора. Например, понижение температуры замерзания раствора, содержащего 1г NaCl в 100 г воды, почти вдвое превышает изменение температуры замерзания, вычисленное по законам Рауля. Во столько же раз и осмотическое давление этого раствора больше теоретической величины. Чтобы распространить уравнение осмотического давления на растворы электролитов, Вант-Гофф ввёл в него поправочный коэффициент i (изотонический коэффициент), показывающий, во сколько раз осмотическое давление данного раствора больше "нормального": 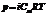 . Коэффициент i определяется для каждого раствора экспериментальным путём - например по понижению давления пара, или по понижению температуры замерзания, или по повышению температуры кипения:
. Коэффициент i определяется для каждого раствора экспериментальным путём - например по понижению давления пара, или по понижению температуры замерзания, или по повышению температуры кипения: 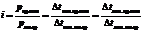
Способность электролитов в растворах проводить электрический ток и их отклонения от законов Рауля и Вант-Гоффа объясняет теория электролитической диссоциации Аррениуса.
 2018-01-21
2018-01-21 883
883








