Если бы электролиты полностью диссоциировали на ионы, то осмотическое давление и другие пропорциональные ему величины всегда были бы в целое число раз больше значений, наблюдаемых в растворах неэлектролитов. Но ещё Вант-Гофф установил, что коэффициент i выражается дробными числами, которые с разбавлением раствора возрастают, приближаясь к целым числам.
Аррениус объяснил этот факт тем, что лишь часть электролита диссоциирует на ионы, и ввёл понятие степени диссоциации. Степенью диссоциации электролита называется отношение числа его молекул, распавшихся в данном растворе на ионы, к общему числу его молекул в растворе.
Позже было установлено, что электролиты можно разделить на две группы: сильные и слабые. Сильные электролиты в водных растворах диссоциированы практически полностью. Слабые электролиты в водных растворах диссоциируют только частично, и в растворе устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. К сильным электролитам принадлежат почти все соли и основания. К слабым электролитам относятся большинство органических кислот, слабые неорганические кислоты, гидрат аммония и др.
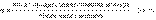
Степень диссоциации принято обозначать греческой буквой альфа и выражать либо в долях единицы, либо в процентах. Степень диссоциации зависит от концентрации. И для слабых, и для сильных электролитов степень диссоциации возрастает при разбавлении раствора, а с ростом концентрации степень диссоциации падает. Но для первых это происходит вследствие образования молекул, а для вторых - вследствие увеличения тормозящего действия ионной атмосферы.
К равновесию, которое устанавливается в растворе слабого электролита между молекулами и ионами, можно применить законы химического равновесия и записать выражение константы рвновесия. Тогда в числителе дроби будут стоять концентрации ионов - продуктов диссоциации, а в знаменателе - концентрация недиссоциированных молекул. Константа равновесия, отвечающая диссоциации слабого электролита, называется константой диссоциации. Величина К зависит от природы электролита и растворителя, а также от температуры, но не зависит от концентрации раствора. Она характеризует способность данной кислоты или данного основания распадаться на ионы: чем выше К, тем легче электролит диссоциирует.
Многоосновные кислоты, а также основания двух- и более валентных металлов диссоциируют ступенчато. В растворах этих веществ устанавливаются сложные равновесия, в которых участвуют ионы различного заряда. Первое равновесие - диссоциация по первой ступени - характеризуется константой диссоциации К1, второе - диссоциация по второй ступени - константой К2 и т.д. Суммарному равновесию отвечает суммарная константа диссоциации К. Эти величины связаны друг с другом соотношением: К=К1К2К3.... Аналогичные соотношения характеризуют и ступенчатую диссоциацию оснований многовалентных металлов.
 2018-01-21
2018-01-21 850
850








