16. При взаимодействии железа с кислородом:
Железо окисляется с образованием оксида
17. Бериллий в отличии от элементов второй группы элементов таблицы Д.И. Менделеева проявляет:
Амфотерные свойства
18. При взаимодействии перманганата калия (марганцовка) с перекисью водорода в присутствии серной кслоты образуются:
Сульфат марганца, сульфат калия, вода и кислород
19. При взаимодействии бромистоводородной кислоы (НВr) с двуокисью марганца образуются:
Бром, вода, бромид марганца
20. CrO3 проявляет:
Окислительые и кислотные свойства
21. Металлы реагируют с неокисляющими кислотами с выделением водорода если:
Стандартный потенциал меньше «0»
22. Активность металлов Pt, Au, Na, Fe, Pb, уменьшается в порядке:
Na, Fe, Pb, Au, Pt
23. Металл может быть получен электролизом водных растворов солей этого металла:
Медь
24. Латунь это сплав:
Меди и цинка
25. Реакция: Me + nHCl = MeCln + H2 xaрактерна для:
Li
Тесты по разделу «Металлы и электрохимический ряд напряжений металлов».
1. Координационное число в кристаллической решетке металлов может быть равным
И 12
2. В узлах кристаллической решетки металлов находятся
Положительно заряженные ионы металла
3. Наибольшей электропроводностью среди металлов обладают
Au, Ag, Cu
4. В химических реакциях металлы выступают в роли
1) восстановителей
5. Электродные потенциалы не зависят от
1) атомной массы металла
6. Промышленная очистка титана от примесей осуществляется
Иодидным способым
7. Промышленная очистка меди от примесей осуществляется
1) электролитическим путем
8. Получение хрома алюмотермическим методом выражается реакцией
3) Cr2О3 + 2А1 → 2Cr + Al2O3
9. Электролизом растворов нельзя получить
Na и Mg
10. При электрохимическом рафинировании меди, содержащей марганец, цинк, золото и серебро в анодный шлам перейдут
Au и Ag
11. При электрохимическом рафинировании меди, содержащей марганец, цинк, железо и серебро в раствор перейдут
Mn, Zn u Fe
12. Стандартные электродные потенциалы соответствуют концентрации иона Men+, равной
1) 1 моль/л
13. Флотационный метод обогащения руды основан на
1) различной смачиваемости минералов
14. Не взаимодействуют с разбавленной соляной кислотой
Cu u Ag
15. Возможным является процесс, описываемый уравнением
1) Zn + CuSO4 → ZnSO4 + Cu
16. Реакция меди с концентрированной азотной кислотой описывается уравнением
4) Cu + 4 HNO3 → Cu(NO3)2 + 2 NO2↑ + 2H2O
17. Реакция меди с разбавленной азотной кислотой описывается уравнением
3) 3Cu + 8 HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O
18. Реакция магния с разбавленной азотной кислотой выражается уравнением
1) 4Mg + 10 HNO3 → 4Mg(NO3)2 + N2O↑ + 5H2O
19. Концентрированная серная кислота не взаимодействует со следующими металлами
Ag u Pt
20. Амфотерными свойствами обладают металлы
Be u Al
21. Не взаимодействуют с водой
Zn u Sn
22. Относятся к легким конструкционным следующие металлы
Mg u Al
23. Из четырех металлов Li, Na, K, Rb наименьший потенциал ионизации имеет
Rb
24. Из четырех металлов Mg, Ca, Sr, Ba наименьшую электроотрицательность имеет
Ba
25. Разбавленная серная кислота не взаимодействует со следующими металлами
Сu u Hg
Тесты по разделу «Строение атома и периодическая система Д.И.Менделеева».
1. Ядерную планетарную модель атома предложил
Резерфорд
2. Принцип неопределенности Гейзенберга описывается уравнением
3) 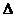 q
q 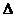 V
V 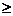 h/m
h/m 
3. Уравнение Де-Бройля имеет вид
1) 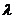 =h/mv
=h/mv
4. Уравнение Шредингера имеет вид
4) H 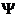 =E
=E 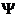
5. Изотопами являются
1) 40Ca и 42Ca
20 20
6. Ядро атома состоит из
Протонов и нейтронов
7. Энергию и размер орбитали характеризует
 2018-01-21
2018-01-21 702
702








