49. Вещество, не взаимодействующее с оксидом фосфора (V):
1. оксид углерода (IV);
50. Реакция, с помощью которой нельзя получить оксид цинка:
1. Zn + HCl 
51. В уравнении реакции K2O + ZnO ;: сумма коэффициентов равна
1. 3;
52. В уравнении реакции SO3 + Al2O3 : сумма коэффициентов равна
1. 5;
53. Водород в промышленности получают следующим способом:
1. действием кислот на активные металлы;
54. Для осушки аммиака его надо пропустить через
1. NaOH;
55. Качественный состав хлорида железа (III) можно установить, используя два раствора, содержащие соответственно ионы
1. CNS- и Ag+;
56. Состав соли (NH4)2SO4 можно установить, используя два раствора, содержащие соответственно ионы
1. OH- и Ba2+;
57. Реакция, являющаяся качественной на ион SO42-:
1. Na2SO4 + BaCl2 = BaSO4 + 2NaCl;
58. Имеются газы: H2S, Cl2, SO2, CO2. Реактив, являющийся лучшим поглотителем всех этих газов:
NaOH.
59. Выделение водорода будет наблюдаться в реакции:
1. Fe + H2SO4 (разб.)
60. Ряд, в котором все вещества при добавлении воды образуют щелочи:
1. Na2O, Li, CaO, K;
61. Ряд, в котором каждое из веществ образует с раствором щелочи осадок малорастворимого основания:
1. CuSO4, FeCl3, Cr(NO3)3.
62. Ряд, в котором каждое из веществ реагирует с оксидом серы (IY):
1. H2O, O2, CaO;
63. Ряд, в котором каждое из веществ реагирует с молекулярным водородом:
1. Fe2O3, Cl2;
64. Ряд, в котором каждое из веществ реагирует с хлороводородной кислотой:
1. MgO, Na2CO3, Fe.
65. Ряд, в котором каждый из металлов реагирует с разбавленной серной кислотой:
1. K, Ca, Ni;
66. Ряд, в котором каждое из веществ взаимодействует с оксидом углерода (IV):
1. Na2O, NaOH.
67. Ряд, в котором каждое из веществ вступает в реакцию с водным раствором карбоната натрия:
1. HNO3, CO2;
68. Ряд, в котором каждый из оксидов пригоден для использования в качестве осушителя (поглотителя воды):
1. P2O5, BaO;
69. Ряд, в котором каждое из веществ можно использовать для получения кислорода лабораторным способом:
1. KMnO4, H2O2, KClO3.
70. Ряд, в котором каждое из веществ несовместимо с присутствием озона:
1. SO2, H2S, KJ, N2.
71. На чашках весов уравновешены стаканчики с растворами гидроксида натрия и хлорида натрия. Через некоторое время стрелка весов
1. отклонится влево;
72. Вещество, с которым взаимодействует сульфид натрия с образованием PbS:
1. Pb(NO3)2;
73. Реагент(ы), в реакции с которым(и) оксид азота (IV) образует только нитрат натрия и воду:
1. NaOH, O2.
74. Продукты, образующиеся при термическом разложении нитрата меди (II):
1. CuO, NO2, O2;
75. Кислота, которую нельзя хранить ни в обычной посуде, ни в посуде из кварцевого стекла:
HF.
76. В трех пробирках находятся растворы хлорида калия, бромида калия и иодида калия. Реактив, с помощью которого можно распознать все соли:
1. AgNO3;
77. В трех пробирках находятся концентрированные растворы кислот: H2SO4, HCl, HNO3. Реактив, с помощью которого можно распознать все кислоты:
1. Zn;
78. Смесь железа, меди и алюминия обработали концентрированной азотной кислотой на холоду. При этом растворились следующие металлы:
Cu.
79. Масса стакана с концентрированной серной кислотой при длительном хранении
1. увеличится;
80. Из перечисленных процессов:
o а) растворение концентрированной серной кислоты в воде;
o б) испарение спирта;
o д) разложение воды
o в) гашение извести;
o г) горение водорода;
к экзотермическим относятся
1. а, в, г;
81. В реакционной системе в равновесии находятся.
Чтобы сместить равновесие реакции вправо, необходимо
1. увеличить давление в системе;
82. Химическое равновесие в системе
сместится в сторону исходных веществ при
1. понижении температуры;
83. Реакция, для которой повышение давления в системе приводит к увеличению выхода продукта реакции:
1. 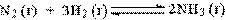 ;
;
84. В 200 мл воды растворили 25 г соли. Массовая доля соли в полученном растворе составляет
1. 11,1%;
85. При растворении кристаллогидрата CaCl2 · 6 H2O массой 219 г в 1000 г воды образовался раствор хлорида кальция с массовой долей
1. 9,1%;
86. Реакция, протекающая без изменения степеней окисления:
1. CaO + H2O ;
87. В реакции, протекающей по схеме
Cr2S3 + KNO3 K2CrO4 + K2SO4 + NO,
окислению подвергаются следующие элементы:
1. S, Cr;
88. Реакция, в которой фосфор выполняет роль окислителя:
1. P + 3K = K3P;
89. Реакция, протекающая практически до конца:
1. CuSO4 + KOH ;
90. Реакция, которую можно использовать для получения гидроксида алюминия:
1. AlCl3 + NaOH (недостаток) ;
91. Вещества, в водных растворах которых растворяется Al(OH)3:
1. KOH, H2SO4;
92. Из приведенных ниже солей гидролизу не подвергается
1. KNO3.
93. В водном растворе кислую реакцию среды имеет
1. NH4Cl;
94. Ряд, в котором водный раствор каждого из указанных веществ имеет щелочную реакцию среды:
1. NaOH, K2CO3;
95. Чтобы ослабить или прекратить гидролиз раствора хлорида железа (III), необходимо немного добавить
1. соляной кислоты;
96. Вещество, которое выпадает в осадок при сливании концентрированных водных растворов Na2S и AlCl3:
1. Al(OH)3;
97. При взаимодействии образца кристаллической соды массой 1,287 г с избытком хлороводородной кислоты выделилось 100,8 мл газа (н.у.). Формула кристаллогидрата имеет вид:
1. Na2CO3 · 10 H2O;
98. При получении меди из сульфата меди (II) необходимо осуществить ряд превращений CuSO4 X Y Cu, промежуточными продуктами которых будут X ____, Y ___________ (впишите формулы веществ). Cu(OH)2 CuO
99. Превращения
можно осуществить с помощью следующих реагентов:
1. X - HСl, Y - AgNO3;
100. Превращения
можно осуществить с помощью следующих реагентов:
1. X - H2SO4, Y - Ba(NO3)2, Z - Na2CO3.
101. Превращения
можно осуществить с помощью следующих реагентов (процессов):
1. X - электролиз расплава, Y - H2O, Z - H2SO4;
102. Масса гидроксида кальция, которую следует прибавить к 162 г 25 %-ного раствора гидрокарбоната кальция для получения средней соли:
1. 18,5 г;
103. При растворении в воде объемом 120 мл оксида фосфора (V) в количестве 0,2 моль получился раствор ортофосфорной кислоты с массовой долей
1. 0,26;
104. Смесь оксидов меди (II) и железа (III) массой 95,5 г восстановили водородом. При действии на продукты избытка хлороводородной кислоты выделилось 4,48 л водорода (н.у.). Масса меди, образовавшейся при восстановлении:
1. 64 г;
105. При пропускании электрического тока через воду образовалось 3,36 л кислорода (н.у.). Количество воды, подвергшейся разложению, составляет
Моль.
106. При полном восстановлении оксида меди (II) массой 79,5 г водородом образовалась металлическая медь массой
1. 63,5 г;
107. Образец стали массой 5 г при сжигании в токе кислорода дал углекислый газ массой 0,1 г. Массовая доля углерода в стали составляет
1. 0,55 %;
108. Объем оксида углерода (IY) (н.у.), необходимый для получения Ca(HCO3)2 из 7,4 г Ca(OH)2, составляет
1. 4,48 л;
109. При взаимодействии кремния с водным раствором NaOH выделилось 3,36 л H2 (н.у.). В реакции использовался технический кремний, содержащий 10% примесей. Его масса, потребовавшаяся для проведения реакции, равна
1. 2,3 г;
110. В алюмотермическом процессе из оксида железа (III) массой 32 г образовалось железо массой 20 г. Практический выход железа от теоретического составил
1. 89,3%;
111. При восстановлении железа из оксида железа (III) алюминием образовалось железо массой 224 г. При этом количество вещества алюминия, вступившего в реакцию, составило
1. 4 моль;
112. Количество вещества и масса гидроксида натрия, необходимые для нейтрализации 14,6%-ного раствора хлороводородной кислоты массой 300 г, равны соответственно
1. 1,2 моль, 48 г;
113. В эвдиометре взорвали смесь, состоящую из 4 мл водорода и 6 мл кислорода. Газ, оставшийся после взрыва, представляет собой O2 ___ (впишите химическую формулу газа) и имеет объем
1. 4 мл;
114. В стакан с 60 г 10%-ного раствора хлороводородной кислоты насыпали 9,2 г железных опилок и оставили стоять без доступа воздуха. На следующий день обнаружили, что в стакане образовалось вещество состава
1. FeOHCl;
115. Вещества, которые можно использовать для устранения общей жесткости воды:
1. Na3PO4, Na2CO3;
116. Временная жесткость воды обусловлена присутствием в воде
1. Ca(HCO3)2, Mg(HCO3)2;
117. Карбонатная жесткость проявляется в результате следующих природных процессов:
1. при взаимодействии известковой почвы с почвенной и дождевой водой, насыщенной атмосферным диоксидом углерода (IV);
118.
образуется конечный продукт (X3) состава
1. Cr2(SO4)3.
119. Одну из двух одинаковых порций гидрокарбоната натрия NaHCO3 прокалили, а затем обе порции раздельно обработали избытком хлороводородной кислоты. В каком случае и во сколько раз объем газа, образовавшегося при действии кислоты, больше? Правильным утверждением является следующее:
1. в случае обработки кислотой непрокаленной порции - в 2 раза;
120. Подберите коэффициенты в уравнении окислительно-восстановительной реакции
K2SO3 + H2SO4 + KMnO4 MnSO4 + K2SO4 + H2O. В ответе укажите в уравнении сумму коэффициентов __ 21 ___.
121. Подберите коэффициенты в уравнении окислительно-восстановительной реакции Na2Cr2O7 + H2SO4 + NaBr Cr2(SO4)3 + Br2 + Na2SO4 + H2O. В ответе укажите в уравнении сумму коэффициентов __ 29 _____.
122. Подберите коэффициенты в уравнении окислительно-восстановительной реакции FeCl2 + HCl + KMnO4 - FeCl3 + Cl2 + MnCl2 + KCl + H2O. В ответе укажите в уравнении сумму коэффициентов _ 60 ___.
123. Уравнение окислительно-восстановительной реакции, в котором правильно подобраны коэффициенты:
1. H2SO4 + H2S = 2H2O + SO2 + S;
124. При полном электролизе раствора хлорида натрия с платиновыми электродами получится раствор, содержащий
1. NaOH;
125. В процессе электролиза водного раствора NaClO4 на электродах выделятся следующие продукты:
1. H2, O2;
126. При электролизе расплава хлорида натрия на аноде выделилось 56 л хлора. Масса образовавшегося металлического натрия равна
1. 115 г;
127. Имеется раствор смеси солей: Na2SO4 и CuSO4. При электролизе этого раствора на катоде будут выделяться следующие вещества в указанной последовательности:
1. Cu, H2;
128. Сплав алюминия и меди обработали избытком раствора гидроксида щелочного металла. При этом выделилось 5,6 л (н.у.) газа. Нерастворившийся остаток отфильтровали, промыли и растворили в азотной кислоте. Раствор выпарили досуха, остаток прокалили. Масса полученного продукта составила 1,875 г. Массовая доля (%) меди в сплаве составляет
1. 25%.
129. При взаимодействии смеси железных и медных опилок с разбавленной серной кислотой выделилось 8,96 л газа (н.у.). При обработке такого же образца концентрированной азотной кислотой образовалась соль, при термическом разложении которой выделилось 11,2 л газа (н.у.). Процентное содержание меди в сплаве составляет
1. 36,4%;
130. При взаимодействии 6,0 г металла с водой выделилось 3,36 л водорода (н.у.). Определите этот металл, если он в своих соединениях двухвалентен. Химическая формула металла _ Ca ___.
131. Растворимость хлорида натрия при 25 С составляет 36,0 г в 100 г воды. Массовая доля соли в насыщенном растворе при этой температуре равна
1. 26,47%;
132. Смешали 100 г 10%-ного раствора хлороводородной кислоты и 100 г 10%-ного раствора гидроксида натрия. Массовая доля хлорида натрия в образовавшемся растворе составляет
1. 7,31%;
133. Какова должна быть массовая доля хлороводорода в соляной кислоте, чтобы в ней на 10 моль воды приходился 1 моль хлороводорода?
1. 16,86%;
134. В воде растворили 11,2 г гидроксида калия. Объем раствора довели до 257 мл. Какова молярная концентрация раствора?
1. 0,78 моль/л;
135. Какую массу медного купороса CuSO4 · 5H2O и воды надо взять для приготовления 40 кг 20%-ного раствора сульфата меди (II)?
1. 12,5 кг CuSO4 · 5 H2O, 27,5 кг H2O.
2.
 2018-01-21
2018-01-21 1313
1313







