Получение.
1. В промыш-сти азот получают путем сжижения воздуха с послед. испарением и отделением азота от других газовых фракций воздуха. Получен.азот содержит примеси благородн.газов (аргона).
2. В лаборатории получают чистый азот термическим разложением нитрата аммония:
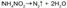
Аммиак
Физич.св-ва: аммиак (NH3) – бесцветный газ с резким запахом, растворим в воде, в 2 раза легче воздуха. Раствор NH3 в воде – аммиачная вода или нашатырный спирт. Мед.нашатырный спирт–10 %. При низкой t образует в растворе кристаллогидрат NH3 * Н2О. Строение молекулы: характерна sp3-гибридизация. В образовании молекулы участвуют 3 неспаренных р-электрона азота и 1s – атомов водорода.
Хим. св-ва:
1) NH3 взаимод. с кислотами: NH3 + Н2SO4 = NH4НSO4;
2) аммиак – сильный вос-ль. Из СuО при нагревании вос-ет Сu: 3СuО + 2NH3 = Сu + N2 + 3Н2О;
3) в кислороде NH3 горит желт. пламенем: 4NH3 + 3О2 = 2N2О+ 6Н2О;
4) водород в NH3 может замещаться на галогены, образуется хлорид азота: NH4Cl + 3Cl2 = 4HCl + NCl3.
Нашатырь (хлорид азота).
Получение: в промыш-сти до концаХ1Х века аммиак получали как побочный продукт при коксовании каменного угля, который содержит до 1–2 % азота.
В начале XX века были разработаны новые промышлен.способы получения аммиака, основанные на связывании или фиксации атмосферн. азота.
В 1904 году появился циамидный способ, основанный на способности азота при высокой t взаимод-ть с карбидом кальция, образуя циамид кальция CaCN2 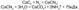
2.Понятие хим. связи
основой хим.связи явилась теория хим. строения А.М. Бутлерова (1861 г.). Главные положения этой теории след.:
1. Атомы в молекулах соединены друг с другом в определ. послед-сти, и изменение этой послед-сти приводит к образованию нового вещества.
2. Соединение атомов происходит в соответствии с их валентностью.
3. Св-ства веществ зависят не только от их состава, но от порядка соединения атомов в молекулах и характера их взаимного влияния.
Под хим. связью понимаются различные виды взаимод-я, обусловливающие устойчивое существование двух и многоатомных соединений: молекул, ионов, кристалич.и иных веществ.
Хим.связь – это взаимод-е атомов, обусловленное перекрытием электрон. облаков связыв-ся частиц, которое сопровождается уменьш. полной энергии системы (молекулы, комплекса, кристалла и т.д.).
К основным чертам хим. связи можно отнести:
а) снижение общей энергии двух или многоатомной системы по сравнению с суммарной энергией изолирован. частиц;
б) перераспределение электрон. плотности в области хим. связи по сравнению с простым наложением электронных плотностей несвязан. атомов, сближенных на расстояние связи.
Хим. связь характ-ся тремя важнейшими параметрами:
1) энергией хим. связи;
2) длиной хим. связи;
3) направленностью хим. связи.
Энергия связи – мера прочности хим. связи, кол-во энергии, выделяющееся при образовании хим. связи. Любая хим.связь образуется с выделением E, для ее разрыва требуется затратить E, равную E связи.
Длина хим. связи – это расстояние между центрами ядер атомов в молекуле (кристалле), когда силы притяжения между атомами уравновешены силами отталкивания и энергия системы минимальна (т.е. достигнуто некот. устойчивое состояние).
Принцип: чем длиннее связь, тем она менее прочная и, соот-но, имеет меньшую Е (т.е. на ее разрыв нужно затратить меньше работы).
Направленность связи показывает, в каком направлении смещается электрон.плотность связи. Обычно это происходит от менее электроотрицат. атома к более электроотрицат.
Группа связей в молекуле может характ-ся и др. параметрами:
1) углами между связями;
2) дипольным моментом;
3) суммарной энергией всех связей.
В соединениях, содержащих более двух атомов, важной характеристикой ой является валентный угол, образуемый хим.связями в молекуле и отражающ. ее геометрию.
Правило октета. В результате образования хим.связи атомы могут приобретать такую электрон. конфигурацию, как у благородн.газов, которые имеют на внешней оболочке 8 (октет) электронов. Стремление к созданию устойчивой электрон.конфигурации - правило октета. Это справедливо как для ионной, так и ковалентной связей.
21.Основные понятия и законы химии
Вещество – вид материи, которая обладает массой покоя, состоит из элементарных частиц: электронов, протонов, нейтронов, мезонов и др. Химия изучает вещ-во, организованное в атомы, молекулы, ионы и радикалы. Такие вещ-ва принято подразделять на простые и сложные(хим.соедин-я).
Атом- наим. частица хим. элемента, не делимая хим. путем, сохраняющая все его свойства, определенные зарядом ядра и электрон. оболочкой. Атомы состоят из полож.заряжен.ядра и отриц.заряжен.электронов. Атом − система взаим-ющих элементарных частиц, состоящая из ядра и электронов. Тип атома опред-ся составом его ядра.
Молекула − микрочастица, образованная из двух или большего числа атомов и способная к самост. существованию (наим. частица вещ-ва, обладающая его хим.св-ами, делимая хим. путем). Имеет постоянный состав (качеств. и количеств.) входящих в нее атомных ядер и фиксированное число электронов и обладает совокупностью свойств, позволяющих отличать одну молекулу от других.
Простые вещества образованы атомами одного хим.элемента (He, O2, O3, H2, S8).
Аллотропия – явление образования химическим элементом нескольких простых веществ, различающихся по строению и свойствам (алмаз, графит; кислород, азон).
Сложные вещ-ва образованы разными элементами и могут иметь состав постоянный (дальтониды) или меняющийся в некот. пределах (бертоллиды) (H2O, H2O2, NH3, CCl4, C2H5OH).
Моль – количество вещества, содержащего столько реальных частиц, сколько атомов содержится в 12 граммах углерода – 12.
Молярная масса M(x) – масса одного моля вещества. По абсолютному значению она равна для простых веществ относит. атомной массе Ar (x), для сложных веществ – относит. молекулярной массе Mr (x), но выражена в г/моль или кг/моль.
Примеры записи: Mr (HCl) = 36,52 и M(HCL) = 36,52 г/моль.
Ar (Br) = 79,91 и М (Вr) = 79,91 г/моль.
Ионы – одноатомные или многоатомные частицы, несущие электрич. заряд. Положительные ионы называются катионами, отрицательные – анионами. В свободном состоянии существуют в газовой форме (в плазме).


Закон Авогадро
Амедео Авогадро открыл в 1811 г. закон. Закон гласит: в равных объемах газа при одинаковых условиях содержится одинаковое число молекул.
Закон Авогадро позволил сделать выводы о числе атомов в молекулах газов, например, таких, как водород, хлор, кислород, азот. Закон применим и для заряженных частиц в газовой фазе (электронов, ионов
Количество молей вещества n(x) находят как отношение массы вещества m к его молярной массе M(x):

Следствия из закона Авогадро.
1. Один моль газообразного вещества содержит одно и то же число молекул, равное 6,023 1023 (NА, число Авогадро):  , где N − число молекул в данном объеме газа.
, где N − число молекул в данном объеме газа.
2. Молярный объем газа. Объем, который занимает 6,02 1023 молекул любого газа при норм. условиях, прибл-но равен 22,4 л. Этот объем наз-ся молярным объемом газа VМ.
Молярный объем газа выражают в единицах: м3/моль (метр кубический на моль) и в л/моль (литр на моль).
Отношение объема, занимаемого веществом V, к его количеству называется молярным V вещ-ва:
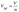 .
.
3. Массы двух газов, взятых в одинаковых объемах, должны относиться друг к другу, как их молекулярные массы или как численно равные им молярные массы, которые равны также отношению плотностей газов:
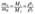 , где ρА, ρВ – плотность вещества А и В, г/см3;
, где ρА, ρВ – плотность вещества А и В, г/см3;
М1, М2 – молекулярные массы газов.
Отношение плотностей двух газов при одинаковых условиях называется относительной плотностью одного газа по другому.
Относительная плотность газа D. Тогда:
 откуда: молярная масса газа равна его плотности по отношению к другому газу, умноженной на молярную массу второго газа.
откуда: молярная масса газа равна его плотности по отношению к другому газу, умноженной на молярную массу второго газа.
Уравнения состояния идеальн.газа. Измерения объемов газов обычно проводят при условиях, отличных от нормальных. Для приведения объема газа к норм.условиям можно пользоваться уравнением, объединяющим газовые законы Бойля − Мариотта и Гей-Люссака:
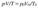 ,где V – объем газа при давлении p и температуре T;
,где V – объем газа при давлении p и температуре T;
V0 – объем газа при норм. давлении p0 (100 кПа) и температуре T0 (273,15 К).
Закон сохранения массы и энергии
Масса (вес) реагентов всегда в точности равна массе (весу) продуктов хим.реа-и. Этот фундамент. закон впервые открыл русский ученый М.В. Ломоносов в 1748 г. Немного позже французский химик А. Лавуазье в 1789 г. пришел к тем же выводам: Масса веществ, вступающих в хим. реакцию, равна массе веществ, образующихся в результате реакции.
Взаим-е водорода и кислорода с образ. воды:  .
.
Коэфф-ы перед формулами химич. соединений наз-ся стехиометрическими.
При хим. реа-ях атомы не исчезают и не возникают из ничего. Общее число атомов при хим. реа-и не изменяется. Масса каждого атома при хим. реа-и и остается постоян., поэтому и общая масса веществ не изменяется.
Закон сохранения энергии:
При любых взаимод-ях, имеющих место в изолированной системе, энергия этой системы остается постоянной и возможны лишь переходы из одного вида энергии в другой.
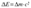 , где с – скорость света в вакууме, равная 3·108м/c.
, где с – скорость света в вакууме, равная 3·108м/c.
Альберт Эйнштейн доказал, что это уравнение справедливо для любых форм материи.
Современ. формулировка закона сохранения массы и энергии: в изолирован. системе сумма масс и энергий постоянна.
Закон постоянства состава
Закон постоянства состава был открыт в 1801–1808 гг. Ж. Прустом и К.Л. Бертолле
Каждое химически чистое соединение всегда имеет один и тот же колич. состав независимо от способов его получения.
Это значит, что соотношения между массами элементов, входящих в состав соединения, постоянны.
На основании этого закона состав веществ выражается хим. формулой с помощью хим.знаков и индексов. Например, Н2О, СН4, С2Н5ОН и т.п.
В 1912–1913 гг. Николай Семенович Курнаков установил, что существуют соединения переменного состава, которые называют бертоллидами. Соединения постоянного состава называют дальтонидами.
Закон постоянства состава всегда выполняется для газообразных и жидких веществ.
Состав соединений молекулярного строения, то есть состоящих из молекул, является постоянным независимо от способа получения.
Закон эквивалентов
В результате работ И. Рихтера был открыт закон эквивалентов (1793 г.): все вещ-ва реагируют друг с другом в количествах, пропорциональных их эквивалентам.
Смысл этого закона: моль эквивалентов одного вещества реагирует точно с молем эквивалентов другого вещества, а n молей эквивалентов одного вещества – с n молями эквивалентов другого вещества.
Эквивалент является важной количествен. характ-ой элемента или вещества. Закон эквивалентов раскрывает связи между качественной и количеств. харак-ами вещества.
Эквивалентом, Э(х)- реальная или условн.частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом равнозначна 1 иону водорода в кислотно-основных или ионно-обменных реа-ях или одному электрону в окислит.-восстановит. реакциях.
Закон кратных отношений
Закон, предложенный Д. Дальтоном гласит: если два элемента образуют между собой несколько различных соединений, то на одну и ту же массу одного из них приходятся такие же массы другого, которые относятся между собой как простые числа.
 2018-01-21
2018-01-21 940
940







