Растворы- гомогенные фазы, состав и свойства которых может изменяться в определенных, часто весьма широких пределах.
1. Идеальные растворы. Физической моделью идеального раствора является совокупность невзаимодействующих частиц, имеющая объем, аддитивно складывающийся из объемов отдельных компонентов. Наиболее важными свойствами идеальных растворов являются: а) Идеальные растворы образуются из чистых компонентов, находящихся в том же агрегатном состоянии, что и раствор, атермально, т.е. без теплового эффекта. б) Объем идеального раствора, образованного из чистых компонентов, находящихся в том же агрегатном состоянии, что и раствор, аддитивно складывается из объемов отдельных компонентов. Основное назначение концепции идеальных растворов – служить эталоном, с которым сравниваются реальные растворы. Все свойства идеальных растворов, в отличие от реальных, легко рассчитываются исходя только из их концентрации и свойств отдельных компонентов.
2. Предельно разбавленные растворы. Предельно разбавленным (п.р.) раствором называют раствор, в котором свойства растворителя практически остались неизменными по сравнению с чистым растворителем ввиду низкой концентрации раствора, в то время как свойства растворенного вещества могут очень сильно отличаться от его свойств в чистом виде ввиду попадания в среду растворителя. Свойствами п.р. растворов обладают обычно все разбавленные растворы вплоть до определенной концентрации, характерной для каждой системы. Чем ближе свойства компонентов, тем до более высокой концентрации сохраняют их растворы свойства п.р. растворов. Для растворов электролитов этот предел очень низок, так как ионы заметно изменяют свойства растворителя уже при миллимолярных концентрациях.
3. Реальные растворы. Различные свойства реальных растворов в той или иной степени отклоняются от идеальных (например, термодинамические). Для адекватного описания этих отклонений обычно требуются различные физические модели, учитывающие межчастичные парные и коллективные взаимодействия, размеры частиц, расстояния между ними и т.д. В некоторых простейших случаях такие модели приводят к результатам, хорошо совпадающим с экспериментом. Однако наиболее универсальный и полностью формальный способ учета неидеальности компонентов раствора был предложен Г. Льюисом в 1907 г., который сохранил ту же форму выражения химического потенциала компонента в реальном растворе, что и в идеальном, но вместо концентрации компонента использовал в нем активности.
По концентрации растворенного вещества растворы можно подразделить на концентрированные (с большой концентрацией растворенного вещества) и разбавленные (с малой концентрацией растворенного вещества).
Важное значение при описании свойств растворов имеет закон Генри: «Масса газа, растворяющегося при постоянной температуре в данном объёме жидкости, прямо пропорциональна парциальному давлению газа». Математически это можно записать так: С=k·р, где k – константа Генри, С – массовая концентрация газа в насыщенном растворе. Важнейшим следствием этого закона является то, что объём газа, раств-ся при постоян. t в данном объёме жидкости, не зависит от его парциального давления.
41. Растворы- гомогенные фазы, состав и свойства которых может изменяться в опред., часто весьма широких пределах. Все газовые смеси, включая воздушную атмосферу, явл-ся истинными растворами со св-ами, близкими к идеальным.
Концентрация рас-ов выражается отношением массы, числа молей или числа эквивалентов растворенного вещества, приходящегося на массу, общее количество молей или объем всего раствора или только растворителя. Растворенными веществами при одинаковом агрегатном состоянии компонентов обычно считаются компоненты, наход-ся в недостатке, в то время как компонент, наход-ся в избытке, счит-ся растворителем. При разных агрегатных состояниях компонентов раствора растворителем обычно считается компонент, агрегатное состояние которого совпадает с агрегатным состоянием ра-ра. Например, в случае жидких растворов твердых и газообразных веществ растворителем всегда считается жидкий компонент, независимо от концентрации растворенных веществ, которая часто превышает 50 масс.%.
Практич. применение в технике и лаб. практике нашли лишь след.способы:
1. Процентная концентрация – отношение массы растворен/вещ-ва mв к общей массе раствора mS:
С%= 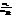 ·100%.
·100%.
Напр., 20% раствор Na2SO4 содержит 20 г Na2SO4 и 80 г H2O.
Этот способ широко распр. в технике и в быту ввиду удобства приготовления, разбавления раст-в, а также практич.расчетов и пересчетов в другие способы выражения концентрации. Недостатком метода является необходимость пересчета в мольные способы выражения концентрации при аналитических и стехиометрических расчетах по химическим формулам вещ-в и схемам хим. реакций.
2. Молярная концентрация (молярность) – число молей растворен.вещ-ва nв, содержащихся в объёме ра-ра:
СМ=М= 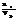 [моль/м3], где Vp – объём раствора, м3 или л.
[моль/м3], где Vp – объём раствора, м3 или л.
27. Координационные (комплексные) соединения относятся к многочисл. классу соединений, в состав которых могут входить как неорганич., так и органич. соединения в виде нейтральных или заряженных частиц. По своей многочисленности они занимают второе место после органических соединений.
К координац. относят любое соединение, образованное присоединением одного или неск.ионов или молекул к одному или более ионам или молекулам. Поэтому такое известное соед-е как нашатырь 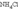 относится к координационным, в котором роль центрального атома играет азот. Формально такие анионы как
относится к координационным, в котором роль центрального атома играет азот. Формально такие анионы как 
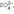
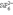 можно считать коорд.: тетрагидридоборат(III), тетраоксосульфат(VI), гексафторосиликат(IV).
можно считать коорд.: тетрагидридоборат(III), тетраоксосульфат(VI), гексафторосиликат(IV).
Совр. Координ. химия связана с именем швейцарского химика А.Вернера, сформулировавшего основные положения координационной теории (1893 г.).
Координационные- соединения, содержащие в 1 из агрегатных состояний группу ионов или нейтральных молекул (лигандов), в определенном порядке размещенных (координированных) вокруг атома (иона) – комплексообразователя.
Система комплексообразователь–лиганды наз-ся внутренней координацион. сферой, обычно отделяемой квадратными скобками от внешней координационной сферы: K4[Fe(CN)6], [Cr(NH3)6]Cl3, [PtCl2(NH3)2], [Cr(CO)6].
Формула координационного иона или молекулы записывается, как правило, слева направо в след. послед-сти: центр.атом (ион), анионные, затем нейтральные лиганды с указанием их числа в виде правого нижнего индекса: [MLmXn]q.
Координацион.соедин.бывают катионные [Cr(NH3)]Cl3, анионные K4[Fe(CN)6], катион-анионные [Cr(NH3)6] [Fe(CN)6] и нейтральные [PtCl2(NH3)2].
Название координацион.соединения электролита начинается с аниона, употребляемого в И.п., затем следует название катиона в родительном падеже. Число лигандов каждого вида обоз-ся греч.приставками ди-, три-, тетра-, пента-, гекса-. Название комплексного аниона составляется из перечисления лигандов, корня латинского наименования центр. атома и суффикса -ат; в скобках римской цифрой обозначается степень его окисления или заряд координ. иона: K2[CuCl4] – тетрахлорокупрат (II) калия; в комплексном катионе металлу-комплексообразователю дается русское название: [Cr(H2O)6]Cl3 – хлорид гексааквахрома (III). Название координационной частицы начинается с перечисления лигандов в алфавитном порядке в последовательности, обратной записи (справа налево). Лиганды сохраняют обычные названия, к анионным лигандам добавляется суффикс «-о», (CH3COO– – ацетато-, F– – фторо-, OH– – гидроксо-), кроме NH3 – аммин-, H2O – аква-, CO – карбонил-, NO – нитрозил-. Например: [Co(NO2)2(NH3)4]Cl – хлорид тетрамминдинитритокобальта(III), [PtCl4(H2O)2] – диакватетрахлорплатина (IV), [Cr(NH3)6][Fe(CN)6] – гексацианоферрат (III) гексамминхрома (III), K3[AlF6] – гексафтороалюминат (III) калия
Важн.параметром комплексообразователя и всего координ.соединения является координ. число (кч), которое наряду со степенью окисления в комплексных соединений служит еще одной его характеристикой.
Координ. числом наз-ют число атомов лигандов, присоединенных к центр. атому. Лиганды харак-ются дентатностью (англ.«dent»–зуб). К лигандам, способным занимать только одно координ. место (монодентатным), относятся H2O, NH3, C5H5N – пиридин (py), другие полярные молекулы (PPh3), однозарядные анионы CN–, Hal–, OH– и т. п. Некот.лиганды могут занимать более одного координ.места, если содержат 2 и более донорных (со свободной электрон.парой) атома. Такие лиганды наз-ют многодентатными: NH2–CH2–CH2–NH2 (en) – этилендиамин, NH2–CH2–COO– (gly) – глицинат.
С учетом дентатности координацион.число атома-комплексообразователя равно произведению числа лигандов во внутр.координацион.сфере комплекса на их дентатность.
5. Вода
Из оксидов водорода самым распр. на Земле является вода. Эмпирическая формула – Н2О. Молек.масса – 18. Строение молекулы воды (структ. формула):
H-O-H
Молекулы воды имеют треуг. формулу: атомы водорода образуют с атомом кислорода угол, равный 104,3 %. Вблизи атома кислорода образуется отрицательно заряженное поле, т. к. наибольшая электрон.плотность сосредотач-ся на атоме кислорода, а вблизи атомов водорода образ-ся положительно заряженное поле – молекула воды – диполь. Вследствие полярности молекулы воды ассоциируют, образуя водородн. связи. Последние обуславливают все физ.свойства воды.
Физ. Св-ва: вода – бесцветная жидкость, без вкуса и запаха, плотность – 1 г/см3; температура замерзания – 0 °C (лед), кипения – 100 °C (пар). При 100 °C и нормальном давлении водородные связи рвутся и вода переходит в газообразное состояние – пар. У воды плохая тепло-и электропроводность, но хорошая растворимость.
Хим. Св-ва: вода незначительно диссоциирует:
H2O-Н+OH
В присутствии воды идет гидролиз солей – разложение их водой с образованием слабого электролита:
Cao+ H2O=Ca(OH)2
Na2O+H2O=2NaOH
Ca+H2O=Ca(OH)2+H2
2Al+6H2O=2Al(OH)3+H2
Взаим-ет со многими основн.оксидами, металлами:
CO2+H2O=H2CO3
3P2O5+3H2O=2H3(PO3)3
С кислотными оксидами:
CO2+H2O=H2CO3
4NO2+H2O+O2=4HNO3
Получение: вода образуется при горении водорода в кислороде: 2Н2 + О2 = 2Н2О
Эта ре-ия протекает мгновенно при 700 °C. Смесь 2 объемов водорода и 1объема кислорода наз-тся гремучей смесью. Методом перегонки пол-ют чистую воду – дистиллированную воду.
Перекись водорода
Пероксид, или перекись водорода – кислородное соединение водорода (перекись). Формула: Н2О2 Физические свойства: перекись водорода – бесцветная сиропообразная жидкость, плотность – 1,45 г/см3относится к числу очень слабых, т. к. в очень малой степени диссоциирует: по I ступени:
H2O2=H+OH
по II ступени:
HO2=H+(O2)2-
Хим/св-ва: при взаим-ии конц.раствора Н2О2 с гидроксидами металлов обр-ся их пероксиды: Na2O2, CaO, MgO2 идр.
BA(OH)2+H2O2=BAO2+2H2O
Пероксиды, или перекиси – это соли Н2О2, состоящие из положительно заряженных ионов металлов и отрицательно заряженных ионов О22-, электронное строение их аниона следующее:
Men+ + 2-n|2
Н2О2 проявляет окислит.-восстановит. св-ва: окисляет вещ-ва стандартный электронный потенциал которых (Е°) не превышает 1,776 В; восстан-ет вещ-ва у которых Е° больше 0,682 В. Окислит.-восстановит.св-ва Н2О2 объясняются тем, что степень окисления -1 у атомов кислорода имеет промежут. значение между степенями окисления -2 и 0. Более характерны для него окислит. Св-ва.
+H2O2=+H2O (2-) 2KI+H2O2= I2+ 2h
Н2О2 здесь выступает окислителем.
2KMnO4+5H2O2+3H2SO4=2MnSO4+5O2+K2SO4+8H2O
Ag2O+H2O2+2Ag+H2O+O2
В этих случаях пероксид водорода является восстановителем.
Соли H2O2 – пероксиды (перекиси) также обладают окислительно-восстановительными свойствами:
2KMnO4+5Na2O2+3HASO4=2MnSO4+5O2+K2SO4+5Na2SO4+8H2O
Здесь Na2O2 – восстановитель.
Получение: в пром-сти H2O2 пол-ют взаимод-ем разб. серной кислотой с пероксидом бария ВаО2: H2SO4(разб.) + ВаО2= ВаSO4 + H2O2, а также путем перегонки пергидроля в вакууме получается конц.пероксид водорода.
29. Началом современ. теории электрон.строения атомов послужила планетарная модель, которую в 1913 г. выдвинул датский физик Нильс Бор
Н. Бор предложил свою теорию строения атома, в которой он согласовал спектральные явления с ядерной моделью атома, применив к последней квантовую теорию излучения, введен. в науку немецким ученым-физиком М. Планком
Сущность теории квантов в том, что лучистая энергия испускается и поглощается не непрерывно, а отдельными малыми, но вполне опред. порциями–квантами энергии.
E=h
V=c/l
где h – постоянная Планка, 6,626∙10-34 Дж ∙ с;
n – частота, гц;
c – скорость света, м/с;
l – длина волны, м.
Н. Бор сформулировал свои постулаты:
1) электрон в атоме нах-ся в «стационарном» состоянии (движется по стационарной орбите) и никакой энергии не излучает;
2) будучи выведен из стационарн. состояния (переведен на другую орбиту), электрон, возвращаясь, излучает квант света:
дельта E=E2-E1=h
3) электрон в атоме может находиться только на тех «разрешенных» орбитах, для которых момент кол-ва движения принимает некие дискретные значения.
Уровни энергии разрешенных орбиталей выглядят след.образом:
– в невозбужд.состоянии электрон находится на ближайшей к ядру орбите, т.е. в основном состоянии;
– он может быть возбужден − переброшен на более высокие, но разрешенные орбитали, а затем вернется в основное состояние, излучая кванты света, отвечающие линейчатому спектру.
Теория Н. Бора позволила разрешить очень важный вопрос о расположении электронов в атомах различных элементов и установить зависимость свойств элементов от строения электронных оболочек их атомов.
Н. Бор определил радиусы (м) разрешенных орбит в атоме водорода:
r = n2h2/4 2me2
или
r=n2(5,29 * 10(-13 cтепени)
где n = 1,2,3,4… – главные квантовые числа;
m – масса электрона;
e – заряд электрона.
Энергия электрона на орбитах:
E= - 2 2(cтеп.) me2(степ.)/n2h2
Достижения теории Н. Бора. Выдвинутая Бором модель атома до сих пор используется в ряде случаев. Она применима для объяснения линий в спектре атомарного водорода. С помощью данной теории можно определить R электрона в атоме водорода. Ею можно пользоваться, объясняя расположение элементов в периодической таблице и закономерности изменения энергий ионизации элементов.
Однако модель Бора имеет несколько недостатков.
1. она не позволяет объяснить некоторые сложные особенности в спектрах элементов, более тяжелых, чем водород, и поведение атомов в магнитном поле.
2. экспериментально не подтверждается, что электроны в атомах вокруг ядра вращаются по круговым орбитам со строго опред. угловым моментом. Более того, если бы это было так, то электрон должен был бы постепенно терять энергию и замедляться. В конце концов, он оказался бы притянутым к ядру, что означает разрушение атома.
14. Двойственная природа электрона. В 1905 г. А. Эйнштейн предсказал, что любое излучение представляет собой поток квантов энергии, называемых фотонами. Из теории Эйнштейна следует, что свет имеет двойственную (корпускулярно-волновую) природу.
В 1924 г. Луи де Бройль (Франция) выдвинул предположение, что электрон также характеризуется корпускулярно-волновым дуализмом. Позднее это было подтверждено на опытах по дифракции на кристаллах. Де Бройль предложил уравнение, связывающее длину волны λ электрона или любой другой частицы с массой т и скоростью ν,
λ = h / (mv)
Волны частиц материи де Бройль назвал материальными волнами. Они свойственны всем частицам или телам. Однако, как следует из уравнения (5), для микротел длина волны настолько мала, что в настоящее время не может быть обнаружена. Так, для тела с массой 1000 кг, двигающегося со скоростью 108 км/ч (30 м/с) λ = 2,21 · 10 – 38 м.
В 1927 г. В. Гейзенберг (Германия) постулировал принцип неопред-сти, согласно которому положение и импульс движения субатомной частицы (микрочастицы) принципиально невозможно определить в любой момент времени с абсолютной точностью. В каждый момент времени можно определить только лишь 1из этих свойств. Э. Шредингер (Австрия) в 1926 г. вывел математич.описание поведения электрона в атоме.
Работы Планка, Эйнштейна, Бора, де Бройля, Гейзенберга, а также Шредингера, предложившего волновое уравнение, заложили основу квантовой механики, изучающей движение и взаимодействие микрочастиц.
ОРБИТАЛЬ – область наиболее вероятного местонахождения электрона в атоме (атомная орбиталь) или в молекуле (молекулярная орбиталь).
Электрон движется в атоме вокруг ядра не по фиксирован.линии-орбите, а занимает некот.область пространства. Напр., электрон в атоме водорода может с опред.веро-тью оказаться либо весьма близко к ядру, либо на значит. удалении, однако существует опред. область, где его появление наиболее вероятно. Графически орбиталь изображают в виде поверхности, очерчивающей область, где вероятность появления электрона наибольшая, где электрон.плотность максимальна. У атома водорода орбиталь электрона имеет сферич. (шаровую) форму:
К наст.моменту описано 5 типов орбиталей: s, p, d, f и g.
Орбитали существуют независимо от того, находится на них электрон (занятые орбитали), или отсутствует (вакантные орбитали). Атом каждого элемента, начиная с водорода и заканчивая последним получен. на сегодня элементом, имеет полный набор всех орбиталей на всех электрон. уровнях. Их заполнение электронами происходит по мере увеличения порядкового N, т.е., заряда ядра.
s -орбитали имеют сферич. форму и, след-но, одинаковую электрон. плотность в направлении каждой оси трехмерных координат:
В совр.химии орбиталь –понятие, позволяющее рассм-ть процессы образования хим. связей и анализировать их св-ва, при этом внимание сосредотачивают на орбиталях тех электронов, которые участвуют в образовании хим.связей, т.е., валентных электронов, обычно это электроны последнего уровня.
На 1 электрон. уровне каждого атома нах-ся только 1 s- орбиталь. Начиная со 2 электрон. уровня помимо s- орбитали появляются также 3 р -орбитали. Они имеют форму объемных восьмерок, именно так выглядит область наиболее вероятного местонахождения р -электрона в районе атомного ядра.
11. Квантово – механическая модель атома. В наст.время строение атома рассм-тся с позиций квантовой или волновой механики, в основе кот-й лежит представление о двойствен. природе электрона: электрон, как и любая частица микромира, обладает одновр-но св-ми частицы (массой m и скоростью
передвижения v) и св-ами волны (длиной волны l):
Волновая механика описывает движение электрона в атоме как распр-ие волны по всему объему атома. Каждое мгновение электрон может нах-ся в любой части пространства вокруг
ядра.
Представление об электрон.облаке – это квантово-механич. модель электрона в атоме. Понятию «электронное облако» соотв-ют также понятия «атомная орбиталь», «квантовая ячейка», «энергетич. ячейка». Электрон.облака (атомные орбитали) могут быть разного размера, различной формы, по-разному ориентированы в пространстве. Все это соотв-ет опред. Энергетич. состоянию электрона.
В многоэлектрон.атомах все электроны распред-ются по энергетич.уровням (электрон.слоям или электрон.оболочкам). В пределах энергетич.уровня электроны распред-ются по подуровням (подоболочкам). Полная харак-ка каждого электрона опред-ся значениями 4 квант. чисел. Многоэлектрон. атом подчиняется принципу Паули: в атоме не может быть 2 электронов с одинаков.значениями всех 4 квантовых чисел:
1. Главное квантовое число (n) харак-ет энергетич.уровень и отражает размеры электрон. облака. n принимает значения целых чисел 1, 2, 3, 4, 5, 6, 7… (или буквавми K, L, M, N, O, P,). С увел-ием n (удалением электрона от ядра) энергия электрона возрастает. Число энергет.уровней в невозбужд. атоме равно номеру периода, в котором нах-ся элемент в периодич.системе. Напр., электроны атома натрия распр-ся по трем уровням, которым соотв-ют значения главного квант. числа n=1 (K), n=2 (L), n=3 (M).
2. Орбитальное квантовое число l характеризует энергетич.подуровень и отражает форму электрон. облака. Усложнение формы электрон.облака связано с возрастанием энергии электрона. Орбит. Квант. число может изображаться буквами s, p, d, f или цифрами, которые в пределах данного энергетич.уровня (с данным значением n)могут принимать целочислен. значения от 0 до (n-1).
Для обозначения подуровня указывают цифрой главное квант. число (т.е. обозначают, в каком уровне нах-ся электрон и каков размер его электрон.облака) и буквой указ-ют орбит.квант. число (т.е. хара-ют форму этого облака). Напр., подуровни 1s, 2s, 2p, 4s, 3d, 5f
16. Энергия ионизации. Энергия, необходимая для удаления 1 моля электронов от одного моля атомов какого либо элемента, наз-тся 1 энергией ионизации I1. В результате ионизации атомы превр-тся в положи-о заряж.ионы. Энергию ионизации выражают либо в (кДж/моль), либо в электронвольтах (эВ).
Na0 – ē = Na+ – 5,14 эв
Cs0 – ē = Cs+ – 3,9 эв
Энергия ионизации харак-ет восстанов. способность элемента, т.е. металличность. Активные Me обладают очень малыми значениями энергии ионизации. Первая энергия ионизации опред-ся электрон. строением элементов и ее изменение имеет периодич. характер. Энергия ионизации возрастает по периоду. Наим. значения энергии ионизации имеют щелочные элементы, находящиеся в начале периода, наиб.значениями энергии ионизации харак-тся благородные газы, находящиеся в конце периода. Пики на кривой зависимости энергии ионизации от порядк. N элемента наблюдаются у элементов с законч. s- подоболочкой (Be, Mg) и d- подоболочкой (Zn, Cd, Hg), и р- подоболочкой, в АО которой находится по 1 электрону (N, P, As). Минимумы на кривой наблюдаются у элементов, имеющих на внешней подоболочке по 1электрону (щелочные Me, В, Al, Ga, In). В одной и той же группе энергия ионизации несколько умен-ся с увелич. порядк. N элемента, что обусловлено увелич-ем размеров атомов и расстояния внешн/ подоболочек от ядра.
Кроме 1 энергии ионизации, элементы с многоэлектрон. атомами могут харак-ться второй I2, третьей I3, и более высокой энергией ионизации, которые равны энергии отрыва молей электронов от молей ионов Э+,Э2+ и т. д. При этом энергии ионизации возрастают с увеличением их N, т.е. I123. Особенно резкое увеличение ионизации наблюдается при отрыве электронов из заполненной подоболочки.
Сродство к электрону. Энергетич. эффект присоединения моля электронов к молю нейтр. атомов наз-тся сродством к электрону. Напр.:
Э + е = Э
Сродство к электрону Еср количественно выражается в кДж/моль или эВ.
F0 + ē = F – + 3,58 эв
I0 + ē = I – + 3,3 эв
Е отражает способность атомов притягивать электроны, т.е. их неметаллич. характер, и увел-тся по периоду слева направо, по группе снизу вверх. Наиб.значения сродства к электрону имеют галогены, кислород, сера, наим. и даже отриц. значения ее - элементы с электрон.конфигурацией s2 (He, Be, Mg, Zn), с полностью или наполовину заполненными p-подоболочками (Ne, Аг, Кг, N, P, As).
Электроотрицательность.(ЭО) Для хар-ки способности атомов в соединениях притягивать к себе электроны введено понятие электроотрицательности (ЭО). Учитывая, что эта способность атомов зависит от типа соединений, валентного состояния элемента, эта характеристика имеет условный характер. Однако ее использование полезно для объяснения типа хим.связей и свойств соединений.
Имеется несколько шкал ЭО. Согласно Р. Малликену (США), ЭО равна полусумме энергии ионизации и энергии сродства к электрону. Сложность использования подхода Малликена заключается в том, что нет надежных методов колич. определения энергии сродства к электрону. Поэтому Л. Полинг (США) предложил термохим. метод расчета ЭО на основе определения разности энергии диссоциации соединения А-В и образующих его молекул А-А и В-В. Он ввел относительную шкалу ЭО, приняв ЭО фтора, равной 4.
ЭО определяет собой арифметич. сумму энергии ионизации и сродства к электрону и является достаточно полной хар-кой химич.активности элементов:
ЭО=I+E (ккал, кдж, эв и др.)
Напр., для F ЭО=415ккал + 95ккал = 510ккал/моль. Пользуются относит. значениями электроотрицательности ОЭО (по шкале Полинга), для чего значение ЭО лития принимают за единицу сравнения и делят на него значения ЭО других элементов. Напр., для фтора:
ЭОF 510
= = 4,1
ЭОLi 128
ЭО элементов возрастает по периоду и несколько убывает в группах с возрастанием номера периода у элементов I, II, V, VI и VII главных подгрупп, III, IV и V — побочных подгрупп, имеет сложную зависимость у элементов III главной подгруппы (минимум ЭО у А1), возрастает с увеличением номера приода у элементов IV — VIII побочных подгрупп. Наим. значения ЭО имеют s-элементы I подгруппы, наибольшие значения — р-элементы VII и VI групп.
Таким образом, наиб. значения ОЭО имеют типичные неметаллы, наим.–активные металлы.
Атомные радиусы. Атомы не имеют строго опред.границ из-за корпускулярно-волнового характера электронов. Поэтому абсолютное значение радиуса атома определить невозможно. Можно условно принять за радиус атома теоретически рассчитанное значение расстояния от ядра до наиболее удаленного от него максимума электрон.плотности - орбитальный радиус атома, или половину расстояния между центрами двух смежных атомов в кристаллах - эффективные радиусы атомов. Наблюдается периодичность изменения атомных радиусов, особенно у s- и p -элементов. У d- и f -элементов кривая изменения радиусов атомов по периоду имеет более плавный характер. В одной и той же группе с увеличением N периода атомные радиусы возрастают в связи с увеличением числа электрон. оболочек. Однако увеличение заряда ядра при этом оказывает противоположный эффект, поэтому увеличение атомных радиусов с увеличением N периода относительно невелико, а в некоторых случаях, напр., у р -элементов III группы, значение орбитального радиуса у А1 больше, чем у Ga
21.Основные понятия в химии
Материя как объективная реальность сущ. В двух формах:вещество и поле. Обе формы находятся в тесной взаимосвязи. Веществом называют такую форму существования материи, в которой она проявляется в виде частиц, имеющих собственную массу покоя. Эта материя на разл.стадиях её организации. Элементарные частицы: e p n, атомные ядра, атомы,молекулы,кристаллы,жидкости,газы,минералы,горные породы,биологические ткани и т.д. Поле(виды полей):гравитационное,электромагнитное,тепловое,внутриядерных сил – это форма существования материи, которая характеризуется энергией,а не массой. Хотя ею и обладает. E=mc^2. Современное учение о материи отражает её дискретность (прерывистость), поскольку любое тело и любое поле есть совокупность элементарных тел для материи и элементарных полей, что бы мы не взяли. Химия – это наука о вещетсвах,о составе,строении,свойствах,превращениях вещ-в и явлениях,сопровождающих эти превращения. В биол.системах протекает свыше миллиона различных химических процессов, в клетке человеческого орг-ма протекают 1000 реакций. Объектом изучения в химии являются:хим.элементы и их соединения. Атом – это наим.частица хим.элемента,сохраняющая все его хим.сво-ва. Каждому хим.элементу соответствует определ.вид атомов,атомы данного элемента хар-ся одинаковыми сво-ами. Молекула – наименьшая частица инд.вещ-ва,способная к сам.существовованию,обладает осн.хим.св-ами и состоит из одинаковых или разл.атомов. молекулы могут быть одно,двух и многоатомными,если молекулы состоят из один.атомов,то вещ-во называют простым. Приведёте примеры простых вещ-в. Простое вещество является формой существования хим.элемента в свободном состоянии. Если молекула вещ-ва состоит из разных атомов,то вещ-во называют сложным или хим.соединением. приведете примеры. Количество вещества – это число структурных элементов,атомов,молекул,ионов,электронов и т.д.в системе. Единицей измерения является моль. Моль – это количество вещ-ва в системе,кото.содержит столько структурных эелементов,молекул,атомов,ионов и т.д.сколько атомов содержится в 0,012кг.углерода. n=0.012 кг/0,012кг = 1.
различают моль молекул,моль атомов и т.д. 1 моль любого вещ-ва содержит 6,022*10^23 структурных единиц,это число наз-ся числом Авогадро.
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Менделеева — Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид: 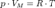 ,где
,где  — давление,
— давление,  — молярный объём,
— молярный объём,  — универсальная газовая постоянная
— универсальная газовая постоянная  — абсолютная температура, К.Так как
— абсолютная температура, К.Так как 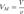 , где
, где  — количество вещества, а
— количество вещества, а 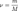 , где
, где 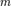 — масса,
— масса,  — молярная масса, уравнение состояния можно записать:
— молярная масса, уравнение состояния можно записать:  Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.Уравнение, выведенное Клапейроном, содержало некую неуниверсальную газовую постоянную
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.Уравнение, выведенное Клапейроном, содержало некую неуниверсальную газовую постоянную  , значение которой необходимо было измерять для каждого газа:
, значение которой необходимо было измерять для каждого газа: 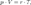 Менделеев же обнаружил, что
Менделеев же обнаружил, что  прямо пропорциональна
прямо пропорциональна  , коэффициент пропорциональности
, коэффициент пропорциональности  он назвал универсальной газовой постоянной. Законы сохранения
он назвал универсальной газовой постоянной. Законы сохранения
В основе современного естествознания лежит общий принцип сохр-ия массы и энергии. Закон сохра-ия m для хим.реакций формулируется:масса вещ-в,вступивших в реакцию=массе вещ-в,образовавшихся в рез-те реакций. При хим.реакциях остаётся постоянной не только общая масса вещ-ва,но и масса каждого из элементов. При хим.реакциях элементы не превращаются друг в друга! Закон сохранения E: энергия системы,включающий вещ-ва,вступившие в реакцию,равна энергии системы,включающей вещ-ва,образующиеся в рез-те реакций. Закон постоянства состава:каждое химически чистое соединение всегда имеет один и тот же количественный состав независимо от способа его получения:Ti+O2=TiO2(диэлектрик), 4Ti+3O2=2TiO3(полупроводник), 2Ti+O2=2TiO(проводник). Дальтониды – всегда подчиняются закону. Бертомиды – не соответствуют закону. Закон эквивалентов:все вещ-ва реагируют в эквивалентных соотношениях. Эквивалентом наз-ют реальную или условную частицу вещ-ва,кот.может замещать,присоединять,высвобождать один ион водорода в ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях:1NaOH+1HCl=1NaCl+1H2O(1:1:1:1), 1NaOH+1/2H2SO4=1/2Na2SO4+1/2H2O
Исходя из закона Авогадро:равные объемы газов при одинаковой температуре и давлении содержат лдин. Число молекул. Следует,что 1 моль любого газа при н.у.занимает V=22,4 л/моль. уравнение Менделеева-Клайперона:PV=m/M*R*T(только для газов!)
3. Растворы
самым распрост.растворителем на Земле явл-ся вода. В массе человека на 70 кг.находится 40кг. Воды. 25кг.приходится на внутриклеточную жидкость и 15кг. На внеклеточную. Плазма крови,внутриплазная жидкость,жидкость жел-киш тракта и т.д. вода растворяет ионные и многие полярные жидкости. Это связано с высокой диэлектрической проницаемостью. У H2O она 80. Это означает,что приятжение между ионами разл.вещ-в уменьшается в 80 раз. В воде хорошо растворяются сахара,альдегиды,кетоны,спирты. Угол между связями – OH составляет 104,5 °. Для воды хар-но образование ассоциатов: (H2O)4 (H2O)6 (H2O)8.
Концентрация растворов
расворы хар-ся качественных и количественным составом.
кол-во растворенного вещества,содержащееся в опред. Кол-ве раствора,наз-ся концентрацией. Если масса растворенного вещества отнесена к определенной массе раствора,то концентрация наз-ся массовой. Если кол-во раствор.вещ-ва относится к объему раствора,то концентрация наз-ся объемной. Массовая концентрация выр-ся в % или массовых долях W(формула). Объемная(мольная) концентрация выр-ся в кол-ве вещ-ва на V р-ра и обозначается C=n/V моль/литр. В аналитической химии применяется концентрация,котороая наз-ся титр и обозначается Т= г/мл.
Растворимость
раствор,содержащий при данной tмаксимальное кол-во растворенного вещ-ва и находящийся в равновесии с избытком растворенного вещ-ва, наз-ся насыщенным. Перенасыщенный раствор – это раствор, концентрация которого выше,чем в насыщенном. Раствор,у которого концентрация меньше насыщенного,наз-ся ненасыщенным. Фундаментальное сво-во веще-ва:способность вещ-ва растворяться в том или ином растворителе,наз-ся растворимостью численно растворимость вещ-ва равна концентрации насыщенного раствора. Обычно растворимость указывается по отношению к 100 г растворителя. Биологическая роль растворимости вещ-в прежде всего связана со способностью растворов проходить через биологические мембраны. Это происходит благодаря диффузии,связанной с осмотическим давлением.
Теория кислот и оснований:
многие электрлиты – гидроксиды элементов проявляют сво-ва как кислот,так и оснований. Кислородсодержащие кислоты можно условно назвать гидроксидами. Диссоциация может протекать по 2 типам:
1)Э-О-Н=ЭО+Н такой гидроксид наз-ся кислотным гидроксидом.
2) Э-ОН=Э+ОН такой гидроксид наз-ся основным.
полярность и прочность связей зависит от разностей электроотрицательностей элементов,а также от размера и эффективности заряда атомов. Если энергия разрыва связей О-Н значительно меньше энергии разрыва связей ЭО,то диссоциация гидроксида протекает по кислотному типу.Е2‹Е1
Если энергия разрыва связи О-Н значительно больше энергии разрыва связи ЭО,то диссоциация протекает по основному типу Е2›Е1.при одинаковой прочности связи диссоциация может протекать как по основному,так и кислотному типу Е2=Е1 – такие вещ-ва наз-ся амфолитами. Определение кислоты по Аррениусу: кислотой наз-ют электролит,диссоциирующий в растворах с образованием ионов Н+. Основанием наз-ют электролит,кот.диссоциирует в растворе с обр-ием как водород ионов,так и гидроксид ионов.Амфолитами наз-ся электролиты,диссоциирующиеся в водных растворах на Н+ и ОН-. Вода – типичный амфолит.Теория Аренниуса применима только для водных растворов. Не подчиняются теории Аррениуса:1)молекула аммиака не сод.иона ОН-,а молекула угл.газа не сод.иона Н+,но в водных ра-рах они проявляют сво-ва основания и кислоты.2)безводный хлороводород реагирует с безводными основаниями 3)многие электролиты,сод.водород в одном растворителе диссоциируют как кислоты,а в другом как основания.
31. Бренстед и Лоури разработали протонную теорию кислот и оснований,по которой:кислотой наз-ют вещ-во,молекулярные частицы которого способны отдавать протон,т.е быть донором протонов. Основанием наз-ют всякое вещ-во,молекулярные частицы которого способны присоединять протоны,т.е. быть акцептором протонов. Согласно протонной теории,кислоты подразделяют на 3 типа:1)нейтральные кислоты:HCl H2SO4 HNO32)катионные кислоты,представляющие собой положительные ионы:NH4 H3O 3)анионные кислоты,представляющие собой отрицательные ионы:H2SO4 Такая же классификация принята и для оснований:1)нейтральные основания:NH3 H2O C2H5OH 2)анионные основания,кот.представляют собой отрицательные ионы:Cl OH CH3COO 3)катионные основания представляют собой положительно заряженные ионы,но их мало:H2N-NH3. Теория Брендстета неприменима к вещ-вам,проявляющим функцию кислоты,но не содержащих водорода: AlCl3 SiCl4. более общей явл-ся теория кислот и оснований Льюиса:кислотой наз-ют вещ-во,принимающее электр.пры – акцептор электронов,а основанием наз-ют вещ-во,поставляющее электроны для обр-ия хим.связи – донор. Взаим-ие между кислотой и основанием заключается в обр-ии хим. Донорно-акцепторной связи между реагирующими частицами. К основаниям Льюиса относят:галогенид-ионы,аммиак,кислородсодержащие соед-ия. К кислотам Льюиса относят:галогениды бора,алюминия,кремния и т.д.
22. Вода.Автопротолиз воды.Кислотность
Химически чистая водаподобно кислотам и солям частично диссоциирует на ионы. Образовавшийся ион Н+ мгновенно гидратируется,присоединяя к себе молекулу Н2О,при этом образуя ион гидроксония Н3О. согласно закону действующих масс константа диссоциации воды выр-ся уравнением: К=[H+][OH-]/[H2O]. К диссоциации воды определена экспериментально и при 20-25 °С она равна=1,8*10^-16 моль/л. Концентрация молекул Н2Оможет быть вычислена как:[H2O]= 1000/18=55,56 моль/л. Вследствие незначит концентрации кол-во недиссициированных молекул воды может быть принято за настоящую величину. [H+][OH-]=[H2O]K [H+][OH]=55.56 моль/л *К -автопротолиз. Произведение концентраций ионов водорода и гидроксила в клюбом водном раст-ре и при постоянной t есть величина постоянная и наз-ся полным произведением воды или константой автоионизации. Растворы,в которых концентрации ионов водорода и гидроксила равны,наз-ся нейтральными. Если к чистой воде прибавить такое кол-во щёлочи,чтобы концентрация гидроксид-ионов повысилась до 10^-4 моль/л,то по принципу Ле Шателье равновесие диссоциации воды сместится и концентрация ионов водорода понизится до 10^-10,а полное произ-ие остается постоянным 10^-14. Если к чистой воде прибавить столько кислоты,чтобы концентрация водород-ионов повысилась до 10^-3 моль/л,тогда концентрация гидроксид-ионов понизится до 10^-11 моль/л. Кислотность и основность р-ра можно характеризовать количественно концентрацией одного из этих компонентов. Для удобства записи обычно используют концентрацию ионов водорода. Также для удобства записей используют не численное значение концентрации [H+],а отрицательный десятичный логарифм концентрации водород-ионов:рН= -log[H+] рН= - log*10^-7 рН=7 Нейтральная среда=7,кислая среда ‹7,щелочная:›7. Одним из сов-в живых орга-мов является кислотно-щелочной гомеостаз,постоянство рН биол.жидкостей,тканей и органов. рН различных жидкостей в орг-ме человека изм. В довольно широких пределах в зав-ти от места нахождения. рН сыворотки крови=7,4 а рН жел сока равна 1. Смещение значений рН крови в кислую среду от норм величины 7,4 наз-ся ацидозом,а в щелочную область алкалозом. Постоянство значений рН поддреживается так называемыми буферными системами. Кислотно-основными буферными системами(р-ами) наз-ся также ра-ры рН которых сохр-ся примерно постоянным при разбавлении или добавлении кислоты или основания.
8. Оксиды халькогенов
Элементы VIA группы и их символы. В неорганической химии халькогенами называют р-элементы VIA группы или подгруппы кислорода периодической системы Д.И. Менделеева. В неё входят пять элементов: кислород О, сера S, селен Se, теллур Te, полоний Po. Название халькогены происходит от греческих χαλχος –медь и γεννάω - рождаю (образующие руды).
Характерное для халькогенов строение внешнего электронного уровня и степени окисления элементов. У атомов халькогенов одинаковое строение внешнего энергетического уровня – ns2np4. Этим объясняется сходство их химических свойств. Для всех элементов (кроме полония и кислорода) характерны степени окисления (+VI), (+IV) и (-II); полоний в соединениях проявляет состояния окисления (+IV), (+II) и (-II); для кислорода типична степень окисления (-II), исключение составляют его фториды OF2 и O2F2 со степенями (+II) и (+I) соответственно и перекись водорода Н2О2, а также её производные, где она равна (-I). Такие значения степеней окисления следуют из электронного строения халькогенов:
У атома кислорода на 2р-подуровне два неспаренных электрона. Его электроны не могут разъединяться, поскольку отсутствует d-подуровень на внешнем (втором) уровне, т.е. отсутствуют свободные орбитали, хотя иногда он может выступать в качестве донора электронов и образовывать дополнительные ковалентные связи по донорно-акцептерному способу. У атомов серы и других элементов подгруппы в невозбужденном состоянии валентность и степени окисления такие же, однако, при подводе энергии (например, при нагревании), число неспаренных электронов может быть увеличено путем перевода s- и р-электронов на d-подуровень внешнего слоя. Устойчивость состояния окисления (+VI) понижается от S к Te, устойчивость состояния (+IV) повышается от S к Po, а устойчивость состояния (-II) понижается от O к Po.
Зависимость физических и химических свойств халькогенов от электронного строения. Физические и химические свойства халькогенов закономерно изменяются с увеличением порядкового номера. Появление новых электронных слоёв влечет за собою увеличение радиусов атомов, уменьшение электроотрицательности, понижение окислительной активности незаряженных атомов и усиление восстановительных свойств атомов со степенью окисления (-II), поэтому с увеличением заряда ядра неметаллические свойства ослабевают, а металлические возрастают от О к Ро. В целом все элементы подгруппы кислорода, кроме полония – неметаллы, хотя и менее активные, чем галогены. Селен и теллур, однако, известны в металлических и аморфных модификациях.
Халькогеноводороды. Водородные соединения элементов подгруппы, они также называются халькогеноводородами (хальководородами), отвечают формуле Н2R: Н2О, Н2S, Н2Se, Н2Те, Н2Ро. Их устойчивость уменьшается от О к Ро. При растворении соединений в воде образуются кислоты (формулы те же), кислотность которых увеличивается в том же порядке, что объясняется уменьшением энергии связи в ряду соединений Н2R. Вода Н2О, диссоциирующая на ионы Н+ и ОН-, является амфотерным электролитом и считается нейтральной. Халькогеноводороды проявляют соответственно большие и меньшие кислотные свойства, чем водородные соединения элементов VА группы и галогеноводороды.
Соединения халькогенов с кислородом (оксиды и гидроксиды). Сера, селен и теллур образуют одинаковые формы соединений с кислородом типа RО2 и RО3, кроме того сера встречается в формах R2О3, (RО3)2, (RО3)3 и RО4. Их гидроксидам соответствуют кислоты типа Н2RО3 и Н2RО4, а также в некоторых случаях Н2RО6 и RО2*nН2О. С ростом порядкового номера элемента сила этих кислот убывает. Все они проявляют окислительные свойства, а кислоты типа Н2RО3 еще и восстановительные. По сравнению с элементами VА группы все указанные гидроксиды более кислотные, а по сравнению с элементами VIIА группы – более основные. Полоний образует амфотерный гидроксид РоО(ОН)2.
9. Химия углерода
Углерод — простое вещество. Вы уже знаете, что углерод образует аллотропные модификации — алмаз и графит.
Алмаз — прозрачное кристаллическое вещество, самое твердое из всех природных веществ. Он служит эталоном твердости, которая по десятибалльной системе оценивается высшим баллом 10. Такая твердость алмаза обусловлена особой структурой его атомной кристаллической решетки. В ней каждый атом углерода окружен такими же атомами, расположенными в вершинах правильного тетраэдра.
Кристаллы алмаза обычно бесцветные, но бывают синего, голубого, красного и черного цветов. Они имеют очень сильный блеск благодаря высокой светопреломляющей и светоотражающей способности.
Алмазы — это не только камни ювелиров. Благодаря исключительно высокой твердости алмазов они применяются для изготовления буров, сверл, шлифовальных инструментов, резки стекла.
Графит — темно-серое, жирное на ощупь кристаллическое вещество с металлическим блеском. В отличие от алмаза графит мягкий (оставляет след на бумаге) и непрозрачный, хорошо проводит тепло и электрический ток. Мягкость графита обусловлена слоистой структурой В кристаллической решетке графита атомы углерода, лежащие в одной плоскости, прочно связаны в правильные шестиугольники. Связи между слоями малопрочны. Он очень тугоплавок.
Из графита изготовляют электроды (вспомните электролитическое получение алюминия), твердые смазки, замедлители нейтронов в ядерных реакторах, стержни для карандашей. При высоких температурах и давлениях из графита получают искусственные алмазы, которые широко применяются в технике.
Сходное с графитом строение имеют сажа и древесный уголь. Древесный уголь получают при сухой перегонке древесины. Этот уголь благодаря своей пористой поверхности обладает замечательной способностью поглощать газы и растворенные вещества. Это свойство называется адсорбцией. Чем больше пористость древесного угля, тем эффективнее адсорбция. Чтобы увеличить поглотительную способность, древесный уголь обрабатывают горячим водяным паром. Обработанный таким способом уголь называют активированным или активным. В аптеках его продают в виде черных таблеток карболена.
Теперь перейдем к рассмотрению химических свойств углерода.
Алмаз и графит соединяются с кислородом при очень высокой температуре. Сажа и уголь взаимодействуют с кислородом гораздо легче, сгорая в нем. Но в любом случае результат такого взаимодействия один — образуется углекислый газ:
С + 02 = С02
С металлами углерод при нагревании образует карбиды, например:
4Аl + ЗС = Аl4С3
Карбид алюминия — светло-желтые прозрачные кристаллы. Вам более известен карбид кальция СаС2 в виде кусков серого цвета. Его применяют газосварщики для получения ацетилена:
СаС2 + 2Н20 = Са(ОН)2 + С2Н2
Ацетилен используют для резки и сварки металлов, сжигая его с помощью кислорода в специальных горелках.
Если водой подействовать на карбид алюминия, то получится другой газ — метан СН4:
Аl4C3 + 12Н20 = 4Аl(ОН)3 + ЗСН4
Если в пробирке прокалить смесь черного порошка оксида меди(II) с порошком древесного угля, то смесь приобретает красный цвет из-за образовавшейся в результате реакции меди:
С + 2СuО = 2Сu + С02
Круговорот углерода в природе. В природе углерод встречается в свободном состоянии (алмаз, графит) и в форме соединений, главным образом карбонатов. Основным карбонатным минералом является кальцит СаС03, который образует известняк, мел и мрамор.
В атмосфере содержится оксид углерода С02 — углекислый газ. Это соединение образуется при дыхании живых организмов и при сгорании топлива. Поэтому в городской местности, вблизи заводов, фабрик и транспорта углекислого газа конечно же больше, чем в сельской местности. Он образуется также при тлении и гниении органических веществ.
Гораздо больше, чем в воздухе, углекислого газа содержится в водах морей и океанов.
Углерод — основная составная часть каменного угля (до 99%), бурого угля (до 72%), а также торфа (до 57%). Теперь вам очевидно происхождение названия углерод, т. е. «рождающий уголь». Аналогично и латинское название карбонеум в основе содержит корень карбо — уголь.
Нефть является смесью соединений углерода, главным образом с водородом. Их так и называют — углеводороды. Понятно, что это в основном жидкие углеводороды. Однако в нефти растворены также газообразные и твердые углеводороды. Углеводороды являются главной составной частью природного газа.
Углерод — это особый химический элемент. Он основа многообразия органических соединений, из которых построены все живые организмы на нашей планете.
Все перечисленные источники углерода участвуют в круговороте его в природе (рис. 43). Из атмосферы и природных вод углекислый газ поглощается зелеными растениями (фотосинтез), а в результате процессов дыхания, брожения, гниения С02 снова поступает в атмосферу и воды морей и океанов. Добываемые из недр земли уголь, нефть и другие углеродсодер-жащие горючие ископаемые при сжигании выделяют С02, поступающий в атмосферу. При разрушении горных пород содержащиеся в них металлы при действии атмосферного С02 образуют осаждающиеся карбонаты.
Большие количества С02 выделяются при извержении вулканов.
10. Строение атома. Модель Резерфорда. Атомные спектры
в 1897 году Томсон открыл существование электрона как элементарную частицу,входящую в состав атома. Масса электрона составляет 9,11*10 ^ -28 г. Тогда же Томсон предложил модель в 1904 году строения атома,в кот. Атом представляется как положительная сфера с вкрапленными в неё отрицательно заряженными электронами. В Англии она получила название модель пудинга. В это же время в 1910 году в лаборатории Эрнста резерфорда шли интенсивные работы по определению сво-в альфачастиц(Не+2). Резерфорд определил,что в составе ядра находятся положительно заряженные частицы и этих частиц может быть несколько. В 1920 году он опубликовал работу, в которой эти положит.частицы он назвал протонами. Резерфорд определил массу электрона,приняв массу протона за 1,и тогда масса электрона относительно приблизительно в 1800 раз меньше массы протона. Модель Резерфорда просуществовала недолго,за дело взялась математика.1)Резерфордовская:в центре атома находится положительно заряженное ядро,занимающее ничтожную часть пространства внутри атома. 2)весь положит.заряд и почти вся масса атома сосредоточены в ядре. Масса электрона 1/1823 массы протона. 3)вокруг ядра вращаются электроны,их число равно положительному заряду ядра.
Развитая Резерфордом ядерная модель была крупным шагом в познании строения атома. Основные черты этой модели — наличие в атоме положительно заряженного тяжелого ядра, окруженного электронами — выдержали испытание временем и подтверждены большим числом экспериментов. Однако модель Резерфорда в некоторых отношениях противоречила твердо установленным фактам. Отметим два таких противоречия. Во-первых, теория Резерфорда не могла объяснить устойчивости атома. Электрон, вращающийся вокруг положительно заряженного ядра, должен, подобно колеблющемуся электрическому заряду, испускать электромагнитную энергию в виде световых волн. Но, излучая свет, электрон теряет часть своей энергии, что приводит к нарушению равновесия между центробежной силой, связанной с вращением электрона, и силой электростатического притяжения электрона к ядру. Для восстановления равновесия электрон должен переместиться ближе к ядру. Таким образом, электрон, непрерывно излучая электромагнитную энергию и двигаясь по спирали, будет приближаться к ядру. Исчерпав всю свою энергию, он должен «упасть» на ядро, — и атом прекратит свое существование. Этот вывод противоречит реальным свойствам атомов, которые представляют собой устойчивые образования и могут существовать, не разрушаясь, чрезвычайно долго. Во-вторых, модель Резерфорда приводила к неправильным выводам о характере атомных спектров. Напомним, что при пропускании через стеклянную или кварцевую призму света, испускаемого раскаленным твердым или жидким телом, на экране, поставленном за призмой, наблюдается так называемый сплошной спектр, видимая часть которого представляет собой цветную полосу, содержащую все цвета радуги. Это явление объясняется тем, что излучение раскаленного твердого или жидкого тела состоит из электромагнитных волн всевозможных частот. Волны различной частоты неодинаково преломляются призмой и попадают на разные места экрана. Для получения спектра вместо призмы можно воспользоваться дифракционной решеткой. Последняя представляет собой стеклянную пластинку, на поверхности которой на очень близком расстоянии друг от друга нанесены тонкие параллельные штрихи (до 1500 штрихов на 1 мм). Проходя сквозь такую решетку, свет разлагается и образует спектр, аналогичный полученному при помощи призмы. Дифракция присуща всякому волновому движению и служит одним из основных доказательств волновой природы света.
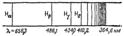
Рис. 3. Схема атомного спектра водорода в видимой области.
Излучение, испускаемое твердыми телами или жидкостями, всегда дает сплошной спектр. Излучение, испускаемое раскаленными газами и парами, в отличие от излучения твердых тел и жидкостей, содержит только определенные длины волн. Поэтому вместо сплошной полосы на экране получается ряд отдельных цветных линий, разделенных темными промежутками. Число и расположение этих линий зависят от природы раскаленного газа или пара. Так, пары калия дают спектр, состоящий из трех линий— двух красных и одной фиолетовой; в спектре паров кальция несколько красных, желтых и зеленых линий и т. д. Такие спектры называются линейчатыми. На рис. 3 приведено в качестве примера изображение атомного спектра водорода в видимой и близкой ультрафиолетовой области. Тот факт, что атомы каждого элемента дают вполне определенный, присущий только этому элементу спектр, причем интенсивность соответствующих спектральных линий тем выше, чем больше содержание элемента во взятой пробе, широко применяется для определения качественного и количественного состава веществ и материалов. Этот метод исследования называется спектральным анализом. Как было указано выше, электрон, вращающийся вокруг ядра, должен приближаться к ядру, непрерывно меняя скорость своего движения. Частота испускаемого им света определяется частотой его вращения и, следовательно, должна непрерывно меняться. Это означает, что спектр излучения атома должен быть непрерывным, сплошным, а это не соответствует действительности. Таким образом, теория Резерфорда не смогла объяснить ни существования устойчивых атомов, ни наличия у них линейчатых спектров. Существенный шаг в развитии представлений о строении атома сделал в 1913 г. Нильс Бор, предложивший теорию, объединяющую ядерную модель атома с квантовой теорией света.
12. Галогены. Общая хар-ка.Получение галогенов
В группу галогенов входят фтор, хлор, бром, иод и астат. Эти элементы составляют VII группу периодической системы Д. И. Менделеева. Электронная конфигурация внешнего слоя у атомов этих элементов ns2np5, где n - номер периода. Всего во внешнем электронном слое атомов галогенов 7 электронов, что предопределяет свойство галогенов присоединять электрон.
Галогены являются сильными окислителями, непосредственно взаимодействуют почти со всеми металлами и неметаллами, за исключением кислорода, углерода, азота и благородных газов. Связь в галогенидах щелочных и щелочноземельных металлов ионная, в остальных - ковалентная.
Галогены образуют двухатомные непрочные молекулы. Легкость распада молекул галогенов на атомы - одна из причин их высокой химической активности.
В свободном состоянии галогены состоят из двухатомных молекул: F2, Cl2, Br2, I2. Астат - радиоактивный элемент и может быть получен только искусственным путем.
От фтора к иоду изменяются физические свойства галогенов: растет плотность, увеличиваются размеры атомов, повышаются температуры кипения и плавления.
С увеличением порядкового номера окислительная способность галогенов в свободном состоянии падает. Поэтому каждый предыдущий галоген вытесняет последующий из его соединений с металлами и водородом, например:
2КСl + F2 = 2КF + Cl2
Фтор - самый активный неметалл. Он проявляет только одну степень окисления -1, непосредственно реагирует почти со всеми металлами (даже с золотом и платиной), а также с неметаллами. Раствор фтороводорода в воде называют плавиковой кислотой, а ее соли называются фторидами. Химическим путем фтор получить невозможно, поэтому используется исключительно электролиз.
Хлор, бром и иод проявляют степень окисления -1 и +1. Степень окисления -1 наиболее характерна для галогенов.
Из-за высокой химической активности галогены в природе существуют только в связанном виде.
Хлор впервые был получен в 1774 г. шведским химиком К. Шееле. Хлор - газ желтоватого цвета с резким запахом, в 2,5 раза тяжелее воздуха. Температура плавления - 101°C, кипения - 34,1°C. Неплохо растворим в воде - один объем воды поглощает примерно 2,5 объемов хлора. Хлор очень ядовит.
Хлор широко используется в промышленности для отбелки тканей, получения соляной кислоты, белильной извести, ядохимикатов, для обеззараживания питьевой воды.
Получение галогенов: фтор получают только электролизом расплавов: KF*HF=H2+F2, хлор можно получить только раствором водных солей: 2NaCl=2Na+Cl2 NaCl+H2O=Cl2+NaOH, бром и йод не получают электролизом:2NaBr+Cl2-2NaCl+Br2. Соединения йода не устойчивы, можно получить возгонкой.
26. Бинарные соединения галогенов.Соединения галогенов с кислородом. Галогены образуют ряд соединений с кислородом. Однако все эти соединения неустойчивы, не получаются при непосредственном взаимодействии галогенов с кислородом и могут быть получены только косвенным путем. Такие особенности кислородных соединений галогенов согласуются с тем, что почти все они характеризуются положительными значениями стандартной энергии Гиббса образования Из кислородсодержащих соединений галогенов наиболее устойчивы соли кислородных кислот, наименее— оксиды кислоты. Во всех кислородсодержащих соединениях галогены, кроме фтора, проявляют положительную степень окисленности, достигающую семи. Фторид кислорода можно получить пропусканием фтора в охлажденный раствор. Реакция идет соглас 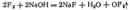 но уравнению: Помимо при этом всегда образуются кислород, озон и пероксид водорода. При обычных условиях — бесцветный газ с резким запахом озона. Фторид кислорода очень ядовит, проявляет сильные окислительные свойства и может служить одним из эффективных окислителей ракетных топлив. Наиболее многочисленны и важны в практическом отношении кислородные соединения хлора, которые мы и рассмотрим несколько подробнее. Как уже указывалось, кислородные соединения хлора могут быть получены только косвенными методами. Рассмотрение путей их образования начнем с процесса гидролиза хлора, т. е. с обратимой реакции между хлором и во
но уравнению: Помимо при этом всегда образуются кислород, озон и пероксид водорода. При обычных условиях — бесцветный газ с резким запахом озона. Фторид кислорода очень ядовит, проявляет сильные окислительные свойства и может служить одним из эффективных окислителей ракетных топлив. Наиболее многочисленны и важны в практическом отношении кислородные соединения хлора, которые мы и рассмотрим несколько подробнее. Как уже указывалось, кислородные соединения хлора могут быть получены только косвенными методами. Рассмотрение путей их образования начнем с процесса гидролиза хлора, т. е. с обратимой реакции между хлором и во 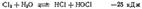 дой в результате которой образуются соляная кислота и хлорноватстая кислота. Гидролиз хлора является реакцией самоокисления-самовосстановления, при которой один из атомов хлора, присоединяя к себе электрон от другого атома, восстанавливается, а другой атом хлора окисляется. Получающиеся при гидролизе хлора и могут взаимодействовать друг с другом, снова образуя хлор и воду, поэтому реакция не идет до конца; равновесие устанавливается, когда прореагирует приблизительно растворенного хлора. Таким образом, хлорная вода всегда содержит наряду с молекулами значительное количество соляной и хлорноватистой кислот. Хлорноватистая кислота — очень слабая кислота (), более слабая, чем угольная; соли ее называются гипохлоритами. Будучи весьма нестойким соединением, хлорноватистая кислота даже в разбавленном растворе постепенно распадается (см. ниже). Хлорноватистая кислота — очень сильный окислитель; ее образованием при взаимодействии хлора с водой объясняются белящие свойства хлора. Совершенно сухой хлор не белит, но в присутствии влаги происходит быстрое разрушение красящих веществ образующейся при гидролизе хлора хлорноватистой кислотой.
дой в результате которой образуются соляная кислота и хлорноватстая кислота. Гидролиз хлора является реакцией самоокисления-самовосстановления, при которой один из атомов хлора, присоединяя к себе электрон от другого атома, восстанавливается, а другой атом хлора окисляется. Получающиеся при гидролизе хлора и могут взаимодействовать друг с другом, снова образуя хлор и воду, поэтому реакция не идет до конца; равновесие устанавливается, когда прореагирует приблизительно растворенного хлора. Таким образом, хлорная вода всегда содержит наряду с молекулами значительное количество соляной и хлорноватистой кислот. Хлорноватистая кислота — очень слабая кислота (), более слабая, чем угольная; соли ее называются гипохлоритами. Будучи весьма нестойким соединением, хлорноватистая кислота даже в разбавленном растворе постепенно распадается (см. ниже). Хлорноватистая кислота — очень сильный окислитель; ее образованием при взаимодействии хлора с водой объясняются белящие свойства хлора. Совершенно сухой хлор не белит, но в присутствии влаги происходит быстрое разрушение красящих веществ образующейся при гидролизе хлора хлорноватистой кислотой.
Тот же результат получится, если непосредственно пропускать хлор в холодный раствор щелочи 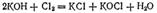 или в ионно-молекулярной форме:
или в ионно-молекулярной форме: 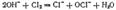 Полученный таким путем раствор солей хлорноватистой и соляной кислот применяется для беления; его белящие свойства обусловливаются тем, что гипохлорит калия легко разлагается уже при действии диоксида углерода, находящегося в воздухе, причем образуется хлорноватистая кислота:
Полученный таким путем раствор солей хлорноватистой и соляной кислот применяется для беления; его белящие свойства обусловливаются тем, что гипохлорит калия легко разлагается уже при действии диоксида углерода, находящегося в воздухе, причем образуется хлорноватистая кислота: 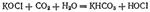 Последняя и обесцвечивает красящие вещества, окисляя их. Аналогичный раствор, содержащий гипохлорит натрия, получается при пропускании хлора в раствор гидроксида натрия. Оба раствора можно получить электролизом растворов хлоридов калия или натрия, если дать возможность выделяющемуся хлору реагировать с образующимися при электролизе щелочами (см, стр. 549). При действии хлора на сухую гашеную известь получается так называемая белильная, или хлорная, известь. Главной ее составной частью является соль, образующаяся согласно уравнению:
Последняя и обесцвечивает красящие вещества, окисляя их. Аналогичный раствор, содержащий гипохлорит натрия, получается при пропускании хлора в раствор гидроксида натрия. Оба раствора можно получить электролизом растворов хлоридов калия или натрия, если дать возможность выделяющемуся хлору реагировать с образующимися при электролизе щелочами (см, стр. 549). При действии хлора на сухую гашеную известь получается так называемая белильная, или хлорная, известь. Главной ее составной частью является соль, образующаяся согласно уравнению: 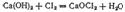 Этой соли отвечает структурная формула, согласно которой следует рассматривать как смешанную соль соляной и хлорноватистой кислот. Хлорная известь представляет собой белый порошок с резким запахом и обладает сильными окислительными свойствами. Во влажном воздухе под действием диоксида углерода она постепенно разлагается, выделяя хлорноватистую кислоту:
Этой соли отвечает структурная формула, согласно которой следует рассматривать как смешанную соль соляной и хлорноватистой кислот. Хлорная известь представляет собой белый порошок с резким запахом и обладает сильными окислительными свойствами. Во влажном воздухе под действием диоксида углерода она постепенно разлагается, выделяя хлорноватистую кислоту: 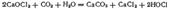 Хлорная известь применяется для отбелки растительного волокна (тканей, бумаги) и для дезинфекции. Образующийся перхлорат калия очень мало растворим в воде и поэтому может быть легко выделен. Действием концентрированной серной кислоты на может быть получена свободная хлорная кислота, представляющая собой бесцветную, дымящую на воздухе жидкость. Безводная малоустойчива и иногда взрывается при хранении, но ее водные растворы вполне устойчивы. Окислительные свойства выражены слабее, чем у, а кислотные свойства— сильнее. Хлорная кислота — самая сильная из всех известных кислот. Соли, за немногими исключениями, к которым относится и, хорошо растворимы и в растворе окислительных свойств не проявляют. Если нагревать хлорную кислоту с, отнимающим от нее воду, то образуется оксид, или хлорный ангидрид,
Хлорная известь применяется для отбелки растительного волокна (тканей, бумаги) и для дезинфекции. Образующийся перхлорат калия очень мало растворим в воде и поэтому может быть легко выделен. Действием концентрированной серной кислоты на может быть получена свободная хлорная кислота, представляющая собой бесцветную, дымящую на воздухе жидкость. Безводная малоустойчива и иногда взрывается при хранении, но ее водные растворы вполне устойчивы. Окислительные свойства выражены слабее, чем у, а кислотные свойства— сильнее. Хлорная кислота — самая сильная из всех известных кислот. Соли, за немногими исключениями, к которым относится и, хорошо растворимы и в растворе окислительных свойств не проявляют. Если нагревать хлорную кислоту с, отнимающим от нее воду, то образуется оксид, или хлорный ангидрид, 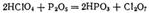 Оксид - маслянистая жидкость, кипящая с разложением при. При ударе или при сильном нагревании взрывается. Изменение свойств в ряду кислоро
Оксид - маслянистая жидкость, кипящая с разложением при. При ударе или при сильном нагревании взрывается. Изменение свойств в ряду кислоро
 2018-01-21
2018-01-21 1140
1140
