С кислородом N образует оксиды: N2O, NO, N2O3 NO2, N2O5 и NO3. Оксид азота I – N2O – закись азота, «веселящий газ». Физические свойства: бесцветный, со сладковатым запахом, растворим в воде, t плавления -91 °C, t кипения -88,5 °C. Анестезирующее средство.
Химические свойства: разлагается при 700 °C: 2N2O?2N2 + O2 поддерживает горение и является окислителем; взаимодействует с водородом: N2+1O + H2?N20+ Н2O.
Получение: NH4NO3?N2O + 2Н2O. N2O соответствует азотноватистая кислота: Н2N2O2, но при действии Н2O и щелочей он не образует ни Н2N2O2, ни ее солей. N2O – несолеобразующий.
Оксид азота (II) NO – окись азота. Физические свойства: бесцветный газ, плохо растворим в воде, t плавления -164 °C, t кипения -152 °C.
Химические свойства: NO обладает окислительно-восстановительными свойствами:
1) при обычной температуре устойчив, при понижении t димеризуется в N2O2;
2) при 700 °C разлагается: 2NO?2N2 + O2? поддерживая горение, является восстановителем;
3) с водородом. Смесь равных объемов NO и H2 взрывается: 2NO + 2H2 = N2? + Н2O, где NO – окислитель;
4) с галогенами: 2NO + Сl2 = 2NOСl? (нитрозилхлорид). NO – несолеобразующий.
Получение:
1) в лаборатории: 3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4H2O;
2) в промышленности: каталитическое окисление аммиака: 4NH3 +5O2 = 4NO? + 6H2O;
3) NO образуется в грозу: N2 + O2 = 2NO?.
Оксид азота (III) N203. Физические свойства: темно-синяя жидкость (при низких t), t плавления -102 °C, t кипения 3,5 °C. Химические свойства: N2O3 – ангидрид азотистой кислоты HN02. При взаимодействии с водой и щелочами соответственно дает НNO2 и ее соли – нитриты: N2O + 2NaOH = 2NaNO2 + H2O.
Получение: NO2 + NO = N2O3.
Оксид азота (IV) – NO2. Физические свойства: ядовитый газ бурого цвета с резким запахом; t плавления —11,2 °C, t кипения – 21 °C. Химические свойства: кислотный ангидрид:
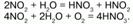
Реагирует со щелочами: 2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O.
Окислитель: N+4O2 + S+4O2 = S+6O3 + N+2O. Димеризуется при низких температурах: 2NO2(бурый газ)?N2O4(бесцветная жидкость).
Получение: 2NO + O2 = 2NO2; Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O. Оксид азота (V) – N2O5. Физические свойства: малостойкое белое кристаллическое вещество. Сильный окислитель. Химические свойства: ангидрид HN03.
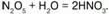
Разлагается со взрывом: 2N2O5?4NO2 + О2.
Получение:
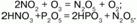
Азотная кислота
Азотная кислота – бесцветная, «дымящаяся» на воздухе жидкость с едким запахом. Химическая формула HNO3.
Физические свойства. При температуре 42 °C застывает в виде белых кристаллов. Безводная азотная кислота закипает при атмосферном давлении и 86 °C. С водой смешивается в произвольных соотношениях.
Под воздействием света концентрированная HNO3 разлагается на оксиды азота:
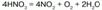
HNO3 хранят в прохладном и темном месте. Валентность азота в ней – 4, степень окисления – +5, координационное число – 3.
HNO3 – сильная кислота. В растворах полностью распадается на ионы. Взаимодействует с основными оксидами и основаниями, с солями более слабых кислот. HNO3 обладает сильной окислительной способностью. Способна восстанавливаться с одновременным образованием нитрата до соединений, в зависимости от концентрации, активности взаимодействующего металла и условий:
1) концентрированная HN03, взаимодействуя с малоактивными металлами, восстанавливается до оксида азота (IV) NO2:
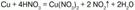
2) если кислота разбавленная, то она восстанавливается до оксида азота (II) NO:
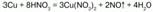
3) более активные металлы восстанавливают разбавленную кислоту до оксида азота (I) N2O:
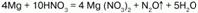
До солей аммония восстанавливается очень разбавленная кислота:
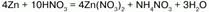
Au, Pt, Rh, Ir, Ta, Ti не реагируют с концентрированной HNO3, а Al, Fe, Co и Cr – «пассивируются».
4) с неметаллами HNO3 реагирует, восстанавливая их до соответствующих кислот, а сама восстанавливается до оксидов:
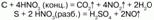
5) HNO3 окисляет некоторые катионы и анионы и неорганические ковалентные соединения.
6) вступает во взаимодействие со многими органическими соединениями – реакция нитрования.
Промышленное получение азотной кислоты: 4NH3 + 5O2 = 4NO + 6H2O.
Аммиак – NO переходит в NO2, который с водой в присутствии кислорода воздуха дает азотную кислоту.
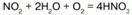
Катализатор – платиновые сплавы. Получаемая HNO3 не более 60 %. При необходимости ее концентрируют. Промышленностью выпускается разбавленная HNO3 (47–45 %), а концентрированная HNO3 (98–97 %). Концентрированную кислоту перевозят в алюминиевых цистернах, разбавленную – в цистернах из кислотоупорной стали.
37. Элементы 1-ой гл.подгруппы
Металлы главной подгруппы первой группы — литий, натрий, калий, рубидий, цезий и франций — называются щелочными металлами. Это название связано с тем, что гидроксиды двух главных представителей этой группы — натрия и калия — издавна были известны под названием щелочей. Из этих щелочей, подвергая их в расплавленном состоянии электролизу, Г. Дэви в 1807 г. впервые получил свободные калий и натрий. Во внешнем электрнном слое атомы щелочных металлов имеют по одному электрону. Во втором снаружи электронном слое у атома лития содержатся два электрона, а у атомов остальных щелочных металлов — по восемь электронов. Имея во внешнем электронном слое только по одному электрону, находящемуся на сравнительно большом удалении от ядра, атомы этих элементов довольно легко отдают этот электрон, т. е. характеризуются низкой энергией ионизации (табл. 30). Образующиеся при этом однозарядные положительные ионы имеют устойчивую электронную структуру соответствующего благородного газа (ион лития — структуру атома гелия, ион натрия — атома неона и т. д.). Легкость отдачи внешних электронов характеризует рассматриваемые элементы как наиболее типичные представители металлов: металлические свойства выражены у щелочных металлов особенно резко. Одинаковое строение не только наружного, но и предпоследнего электронного слоя атомов всех щелочных металлов, кроме лития, обусловливает большое сходство свойств этих элементов. В то же время увеличение заряда ядра и общего числа электронов в атоме при переходе сверху вниз по подгруппе создает некоторые различия в их свойствах. Как и в других группах, эти различия проявляются главным образом в увеличении легкости отдачи валентных электронов и усилении металлических свойств с возрастанием порядкового номера.
38. Ионная и металлическая связи
Металлическая связь — химическая связь, которая обусловлена взаимодействием положительных ионов металлов, составляющих кристаллическую решётку, с электронным газом из валентных электронов. В узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся валентные электроны, происходящие из атомов металлов от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены. Поэтому в большинстве случаев проявляются высокие координационные числа (например, 12 или 8).Так, щелочные металлы кристаллизуются в кубической объёмно-центрированной решётке, и каждый положительно заряженный ион щелочного металла имеет в кристалле по восемь ближайших соседей — положительно заряженных ионов щелочного металла (рис.1). Кулоновское отталкивание одноимённо-заряженных частиц (ионов) компенсируется электростатическим притяжением к электронам связывающих звеньев, имеющих форму искажённого сплющенного октаэдра — квадратной бипирамиды, высота которой и рёбра базиса равны величине постоянной трансляционной решётке aw кристалла щелочного металла (рис.2).Связывающие электроны становятся общими для системы из шести положительных ионов щелочных металлов и удерживают последние от кулоновского отталкивания.Величина постоянной трансляционной решётки aw кристалла щелочного металла значительно превышает длину ковалентной связи молекулы щелочного металла, поэтому принято считать, что электроны в металле находятся в свободном состоянии:
39. Элементы 2-ой гл.подгруппы.
В главную подгруппу II группы входят элементы магний, кальций, стронций, барий и радий. Все эти элементы, кроме бериллия, обладают ярко выраженными металлическими свойствами. В свободном состоянии они представляют собой серебристо-белые вещества, более твердые, чем щелочные металлы, с довольно высокими температурами плавления. По плотности все они, кроме радия, относятся к легким металлам. Их важнейшие свойства приведены в табл. 32. Первые два члена рассматриваемой подгруппы занимают в ней несколько особое положение, отличаясь во многих отношениях от остальных четырех элементов. Бериллий по некоторым своим свойствам приближается к алюминию («диагональное сходство» — см. стр. 590). Все изотопы последнего элемента подгруппы — радия — радиоактивны. Долгоживущий изотоп раньше использовался в радиотерапии; в настоящее время его заменили более дешевыми изотопами других элементов, образующимися в ядерных реакторах. =В наружном электронном слое атомы элементов этой подгруппы имеют два электрона, во втором снаружи слое у бериллия находится два электрона, а у остальных элементов — восемь. Два электрона внешнего слоя сравнительно легко отщепляются от атомов, которые превращаются при этом в положительные двухзарядные ионы. Поэтому в отношении химической активности эти элементы лишь немного уступают щелочным металлам. Подобно последним, они довольно быстро окисляются на воздухе и могут вытеснять водород из воды при комнатной температуре. Однако бериллий и магний взаимодействуют с водой очень медленно, так как образующиеся при этом гидроксиды малорастворимы в водез покрывая поверхность металла, они затрудняют дальнейшее течение реакции. Остальные четыре металла ввиду лучшей растворимости их гидроксидов реагируют с водой значительно энергичнее. Входящие в состав главной подгруппы кальций, стронций и барий издавна получили название щелочноземельных металлов. Происхождение этого названия связано с тем, что гидроксиды кальция, стронция и бария, так же, как и гидроксиды натрия и калия, обладают щелочными свойствами, оксиды же этих металлов по их тугоплавкости сходны с оксидами алюминия и тяжелых металлов, носившими прежде общее название земель. При сжигании щелочноземельных металлов всегда получаются оксиды. Пероксиды, поскольку они вообще образуются, гораздо менее стойки, чем пероксиды щелочных металлов. Оксиды кальция, стронция и бария непосредственно соединяются с водой, образуя гидроксиды. Растворимость последних сильно увеличивается при переходе от кальция к следующим щелочноземельным металлам. В такой же последовательности увеличиваются и основные свойства гидроксидов. Щелочноземельные металлы могут соединяться с водородом, образуя гидриды, аналогичные гидридам щелочных металлов (на пример,). Замечательна склонность щелочноземельных металлов соединяться с азотом, возрастающая по мере увеличения их атомной массы. Уже при комнатной температуре щелочноземельные металлы медленно соединяются с азотом, образуя нитриды. В отличие от солей щелочных металлов, многие из солей щелочноземельных металлов малорастворимы в воде. К таким солям относятся карбонаты, сульфаты, фосфаты и некоторые другие. Во всех своих соединениях щелочноземельные металлы имеют степень окисленности.
40. Электронное стоение и хим.св-ва РЗЭ
Редкоземе́льные элеме́нты — группа из 17 элементов, включающая лантан, скандий, иттрий и лантаноиды. Все эти элементы — металлы серебристо-белого цвета, при том все имеют сходные химические свойства (наиболее хар Название «редкоземельные» (встречается сокращение TR, ср. лат. terrae rarae — «редкие земли») дано в связи с тем, что они, во-первых, сравнительно редко встречаются в земной коре (содержание (1,6-1,7)·10−2% по массе) и, во-вторых, образуют тугоплавкие, практически не растворимые в воде оксиды (такие оксиды в начале XIX века и ранее назывались «землями»).актерна степень окисления +3). Редкоземельные элементы проявляют между собой большое сходство химических и некоторых физических свойств, что объясняется почти одинаковым строением наружных электронных уровней их атомов. Редкоземельные элементы — металлы, их получают восстановлением соответствующих оксидов, фторидов, электролизом безводных солей и другими методами. Скандий, иттрий и лантаноиды имеют высокую реакционную способность. Химическая активность этих элементов особенно заметна при повышенных температурах. При нагревании до 300—400 °C металлы реагируют даже с водородом, образуя RH3 и RH2 (символ R выражает атом редкоземельного элемента). Эти соединения достаточно прочные и имеют солевой характер. При нагревании в кислороде металлы легко реагируют с ним, образуя оксиды: R2O3, CeO2, Pr6O11, Tb4O7 (лишь только Sc и Y при помощи образования защитной оксидной плёнки являются стойкими на воздухе, даже при нагревании до 1000 °C). Во время горения данных металлов в атмосфере кислорода выделяется большое количество тепла. При сгорании 1 г лантана выделяется 224,2 ккал тепла. Для церия характерной особенностью является свойство пирофорности — способность искриться при разрезании металла на воздухе.Лантан, церий и другие металлы уже при обычной температуре реагируют с водой и кислотами-неокислителями, выделяя водород. Из-за высокой активности к атмосферному кислороду и воде куски лантана, церия, иттрия и др. следует хранить в парафине.Химическая активность редкоземельных металлов неодинакова. От скандия до лантана химическая активность возрастает, а в ряду лантан — лютеций — снижается. Отсюда следует, что наиболее активным металлом является лантан. Это обуславливается уменьшением радиусов атомов элементов от лантана до лютеция с одной стороны, и от лантана до скандия — с другого.Эффект «лантаноидной контракции» (сжатия) приводит к тому, что следующие после лантаноидов элементы (гафний, тантал, вольфрам, рений, осмий, иридий, платина) имеют уменьшенные радиусы атомов на 0,2—0,3 Å отсюда и очень схожие их свойства со свойствами соответствующих элементов пятого периода.В элементах — скандий, иттрий, лантан — d -оболочка предпоследнего электронного слоя только начинает образовываться, поэтому радиусы атомов и активность металлов в этой группе возрастают сверху вниз. Этим свойством группа отличается от других побочных подгрупп металлов, у которых порядок изменения активности противоположный.Поскольку радиус атома иттрия (0,89 Å) близок к радиусу атома гольмия (0,894 Å), то по активности этот металл должен занимать одно из предпоследних мест. Скандий же из-за своей активности должен располагаться после лютеция. В этом ряду ослабляется действие металлов на воду.Редкоземельные элементы чаще всего проявляют степень окисления +3. Из-за этого наиболее характерными являются оксиды R2O3 — твёрдые, крепкие и тугоплавкие соединения. Будучи основными оксидами, они для большинства элементов способны соединяться с водой и создавать основания — R(OH)3. Гидроксиды редкоземельных металлов малорастворимы в воде. Способность R2O3 соединяться с водой, основная функция, то есть и растворимость R(OH)3 уменьшаются в той же последовательности, что и активность металлов: Lu(OH)3, а особенно Sc(OH)3, проявляют некоторые свойства амфотерности. Так, кроме раствора Sc(OH)3 в концентрированном NaOH, получена соль: Na3Sc(OH)6·2H2O.Поскольку металлы данной подгруппы активны, а их соли сильных кислот растворимы, они легко растворяются в кислотах-неокислителях и кислотах-окислителях.Все редкоземельные металлы энергично реагируют с галогенами, создавая RHal3 (Hal — галоген). С серой и селеном они также реагируют, но при нагревании. Как правило, редкоземельные элементы встречаются в природе совместно. Они образуют весьма прочные окислы, галоидные соединения, сульфиды. Для лантаноидов наиболее характерны соединения трёхвалентных элементов. Исключение составляет церий, легко переходящий в четырёхвалентное состояние. Кроме церия четырёхвалентные соединения образуют празеодим и тербий. Двухвалентные соединения известны у самария, европия и иттербия. По физико-химическим свойствам лантаноиды весьма близки между собой. Это объясняется особенностью строения их электронных оболочек.Редкоземельные элементы используют в различных отраслях техники: в радиоэлектронике, приборостроении, атомной технике, машиностроении, химической промышленности, в металлургии и др. Широко применяют La, Ce, Nd, Pr в стекольной промышленности в виде оксидов и других соединений. Эти элементы повышают светопрозрачность стекла. Редкоземельные элементы входят в состав стекол специального назначения, пропускающих инфракрасные лучи и поглощающих ультрафиолетовые лучи, кислотно- и жаростойких стекол. Большое значение получили редкоземельные элементы и их соединения в химической промышленности, например, в производстве пигментов, лаков и красок, в нефтяной промышленности как катализаторы.
 2018-01-21
2018-01-21 4982
4982
