Задание №1.
Составьте электронные формулы для указанных элементов.
К какому семейству (s,p,d,f) они относятся?
Покажите распределение электронов по энергетическим ячейкам?
Определите валентные электроны.
Определите валентность в невозбужденном и возбужденном состояниях.
Порядковый номер элемента 16. Это сера.
S 1s22s22p63s23p4
Сера относится к р-элементам.
|
|
|
|
|
|
|
|
|
Валентные электроны серы - 3s23p4.
В невозбужденном состоянии атома валентность серы равна 2 (два неспаренных электрона).
Рассмотрим возбужденные состояния.
3d
|
|
|
|
|
|
|
|
|
|
Валентность серы равна 4 (4 неспаренных электрона).
3d
|
|
|
|
|
|
|
|
|
|
|
Валентность серы равна 6 (6 неспаренных электронов).
Порядковый номер элемента 48. Это кадмий.
Cd 1s22s22p63s23p64s23d104p65s24d10
Кадмий относится к d-элементам.
|
|
|
|
|
|
Валентные электроны кадмия 4d105s2.
В нормальном состоянии валентность кадмия равна 0 (т.к. нет неспаренных электронов).
Рассмотрим возбужденное состояние.
|
|
|
|
|
|
|
В возбужденном состоянии валентность кадмия равна 2 (2 неспаренных электрона).
Задание №2.
Выведите электроно-точечные формулы молекул и ионов.
Определите тип гибридизации.
Установите геометрическую форму молекулы или иона.
4.Определите характер связей (ионная, ковалентная), наличие и число π-связей.
Молекула ClF5.
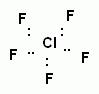
Тип гибридизации sp3d2 (связь образована смешением одной s-, трех р- и двух d-орбиталей).
Форма молекулы: квадратная пирамида.
Определим разность электроотрицательностей фтора и хлора.
Δ = ОЭО(F) – ОЭО(Cl) = 3,98 – 3,16 = 0,82
Т.е. связь ковалентная полярная.
В данном соединении π-связи отсутствуют.
Ион AsO43-.
O
::
· O: As: O ·
:
О ·
Тип гибридизации sp3. Форма иона: тетраэдр
Определим разность электроотрицательностей:
Δ = ОЭО(О) – ОЭО(As) = 3,5 – 2,0 = 1,5
Связь ковалентная полярная.
В данном соединении присутствует одна π-связь.
Задание 3.
Укажите, какие из приведенных реакций протекают самопроизвольно и являются экзотермическими:
А) 2Н2О2(ж) = 2Н2О(ж) + О2(г)
Б) 3Н2(г) + N2(г) = 2NH3(г)
В) N2O4(г) = 2NO2(г)
А) 2Н2О2(ж) = 2Н2О(ж) + О2(г)
Выпишем справочные данные для веществ, участвующих в реакции:
| Н2О2(ж) | Н2О(ж) | О2(г) | |
| ΔН0298, кДж/моль | -187,9 | -285,8 | |
| S0298, Дж/моль·К | 109,6 | 70,0 | 205,0 |
Изменение энтальпии для данной реакции равно:
ΔНр = 2 ΔН0298(Н2О(ж)) - 2 ΔН0298(Н2О2(ж)) = 2(-285,8) – 2(-187,9) = -195,8 кДж
Изменение энтропии для данной реакции равно:
ΔS = 2S0298(Н2О(ж)) + S0298(О2(г)) - 2S0298(Н2О2(ж)) = 2·70,0 + 205,0 - 2·109,6 = 125,8 Дж/моль·К
ΔG = ΔH – TΔS = -195,8 – 298 ·0,1258 = -233,29 кДж
Т.к. ΔG < 0, реакция протекает самопроизвольно. Реакция является экзотермической, т.к. ΔН < 0.
Б) 3Н2(г) + N2(г) = 2NH3(г)
Выпишем справочные данные для веществ, участвующих в реакции:
| Н2(г) | N2(г) | NH3(г) | |
| ΔН0298, кДж/моль | -45,9 | ||
| S0298, Дж/моль·К | 130,6 | 199,9 | 192,6 |
ΔНр = 2 ΔН0298(NH3(г)) = 2(-45,9) = -91,8 кДж
ΔS = 2S0298(NH3(г)) - 3S0298(Н2(г)) - S0298(N2(г)) = 2·192,6 - 3·130,6 – 199,9 = -206,5 Дж/моль·К
ΔG = ΔH – TΔS = -91,8– 298 ·(-0,2065) = -30,26 кДж
Т.к. ΔG < 0, реакция протекает самопроизвольно. Реакция является экзотермической, т.к. ΔН < 0.
В) N2O4(г) = 2NO2(г)
| N2O4(г) | NO2(г) | |
| ΔН0298, кДж/моль | 11.1 | 34.2 |
| S0298, Дж/моль·К | 304.3 | 240.1 |
ΔНр = 2 ΔН0298(NO2(г)) - ΔН0298(N2O4(г)) = 2·34,2 – 11,1 = 57,3 кДж
ΔS = 2S0298(NО2(г)) - S0298(N2O4(г)) = 2·240,1 – 304,3 = 175,9 Дж/моль·К
ΔG = ΔH – TΔS = 57,3– 298 ·0,1759 = 4,8 кДж
Т.к. ΔG > 0, реакция не протекает самопроизвольно. Реакция не является экзотермической, т.к. ΔН > 0.
Задание №4.
8.Реакция протекает по уравнению Na2S2O3 + H2SO4 = Na2SO4 + H2SO3 + S. Как изменится скорость реакции после разбавления реагирующей смеси в 4 раза?
Скорость реакции в начальный момент равна:
V = K·[Na2SO4]·[H2SO4]
При равных концентрациях и разбавлении реагирующей смеси в 4 раза получаем скорость реакции:
V' = K·([Na2SO4]/4)·([H2SO4]/4) = (1/16)·V
Таким образом, разбавление в 4 раза замедлит реакцию в 16 раз.
Ответ: уменьшится скорость в 16 раз
Задание №5.
1.Написать уравнения диссоциации следующих электролитов:
H3PO4 → H+ + H2PO4-
H2PO4- → H+ + HPO42-
HPO42- → H+ + PO43-
Al(NO3)3 → Al3+ + 3NO3-
2.Написать в молекулярной и молекулярно-ионной формах следующие уравнения:
NaHCO3 + NaOH → Na2CO3 + H2O
Na+ + HCO3- + Na+ + OH- → 2Na+ + CO32- + H2O
Ca(NO3)2 + K2SO3 → CaSO3 + 2KNO3
Ca2+ + 2NO3- + 2K+ + SO32- → CaSO3 + 2K+ + 2NO3-
3.Составить по два молекулярных уравнения реакции к каждому молекулярно-ионному уравнению:
CN- + H+ = HCN
KCN + HCl = HCN + KCl
2NaCN + H2SO4 = 2HCN + Na2SO4
Ba2+ + SO42- = BaSO4
BaCl2 + Na2SO4 = BaSO4 + 2NaCl
Ba(NO3)2 + H2SO4 = BaSO4 + 2HNO3
Задание №6.
Запишите уравнения гидролиза солей в молекулярной и ионной формах, укажите рН раствора.
Соль KClO образована сильным основанием KOH и слабой кислотой HClO. Гидролиз будет протекать по аниону.
KClO + H2O = HClO + KOH
K+ + ClO- + H2O = HClO + K+ + OH- рН>7(щелочная среда)
Соль CdCl2 образована сильной кислотой HCl и слабым основанием Cd(OH)2. Гидролиз будет протекать по катиону.
CdCl2 + H2O = CdOHCl + HCl
Cd+ + 2Cl- + H2O = CdOH+ + Cl- + H+ + Cl-
CdOHCl + H2O = Cd(OH)2 + HCl
CdOH+ + Cl- + H2O = Cd(OH)2 + H+ + Cl- pH<7 (кислая среда)
 2018-01-21
2018-01-21 2341
2341