Ü При разбавлении раствора слабого электролита степень диссоциации увеличивается
CH3COOH D CH3COO- + H+
C(1 – a) C × a C × a
C2 × a2 C × a2
КД = ------------- = -----------
C(1 – a) 1 – a
Для слабых электролитов (1 – a)» 1;
К
КД = C × a2; a = Ö-------
С
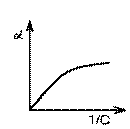
Ü Зависимость степени диссоциации от разведения
Ü a = 1 при бесконечном разведении
Теория сильных электролитов
Ü В водных растворах электролитов концентрация ионов велика
Ü Расстояние между отдельными ионами невелико; между ними существуют силы межионного взаимодействия (притяжения или отталкивания)
Ü Каждый ион в растворе сильного электролита будет окружен ионной сферой с противоположным знаком заряда. Ионная сфера затрудняет движение иона
Ü Диссоциация многих сильных электролитов не только полная, но и необратимая
Релаксационный эффект
Ионная сфера и гидратная оболочка тормозят движение иона
Электролит проявляет меньшую степень диссоциации, чем это соответствует химическим расчетам – кажущаяся степень диссоциации
Активность иона а
Ü Та эффективная условная концентрация иона, соответственно которой он действует при химических реакциях
а = f ×С
а – активность электролита
С – аналитическая концентрация
f – коэффициент активности
Ü При очень больших концентрациях растворов некоторых электролитов f может быть больше 1, а > С. Это объясняется нехваткой молекул растворителя для гидратации ионов и резким увеличением подвижности ионов
Ü При очень большом (бесконечном) разведении f = 1, а = С (силы взаимодействия между ионами = 0). У сильных электролитов это возможно при С < 0,0001 моль/л
Ионная сила раствора I
Ü Величина, измеряемая полусуммой произведений концентраций каждого иона на квадрат его заряда
I = ½(С1 × z12 + C2 × z22 + …)
0,01 М CaCl2
I = ½(0,01 × 22 + 0,01 × 12) = 0,03
Для разбавленных растворов, ионная сила которых не превышает 0,01, коэффициент активности конкретного иона связан с ионной силой раствора:
f = -0,5 z2ÖI
Закон Дебая-Хюккеля
Ü В разбавленных растворах сильных электролитов с одинаковой ионной силой коэффициенты активности катионов и анионов одинаковой зарядности равны, независимо от их химической природы
Два уравнения из предыдущего слайда являются математическим выражением этого закона
Ü Активность ионов является эффективной концентрацией, проявляющей себя при химических реакциях
Ü Если пользоваться активность вместо концентрации, то закон действующих масс можно применить к сильным электролитам и к концентрированным растворам слабых электролитов
 2018-01-21
2018-01-21 736
736








